Данная информация предназначена для специалистов в области здравоохранения и фармацевтики. Пациенты не должны использовать эту информацию в качестве медицинских советов или рекомендаций.
ГЛАВА 11. НАРУШЕНИЯ ГЕМОДИНАМИКИ
Как известно (Зильбер А.П., 1984), гемодинамические нарушения и
гиповолемия той или иной степени выраженности сопровождают любую тяжелую
патологию, и в том числе патологию периода новорожденности. Почти всегда они
присутствуют при состояниях, требующих проведения реанимационных мероприятий и
интенсивной терапии. Кроме того, они, как правило, плохо диагностируются и
своевременно не устраняются. Поскольку, по нашему мнению, трактовка причин
нарушений гемодинамики часто бывает ошибочной, то, перефразируя Зильбера А.П.
(1984), считаем необходимым указать на наиболее часто встречающиеся ошибки.
Во-первых, это бессознательное уравнивание понятий «давление» –
даже не давление, а именно артериальное давление и кровоток, а также понятий
«артериальная гипотензия» и «шок». При этом чаще всего врач не имеет объективных
методов оценки гемодинамики или просто не применяет их, считая артериальное
давление единственным показателем кровотока. Хотя давно хорошо известно (Фолков
Б., Нил Э., 1976), что артериальное давление – очень условный критерий состояния
гемодинамики, а ее главный показатель – объемный кровоток, прямо
пропорциональный артериальному давлению и обратно пропорциональный сосудистому
сопротивлению. Не смотря на эти представления, до сегодняшнего дня в
неонатологии и не только у нас в стране, но и за рубежом (Evans N., 2006)
артериальное давление рассматривается пропорционально системному, а часто и
органному кровотоку, например мозговому. Именно это часто определяет лечебную
тактику. Например, при артериальной гипотензии назначается адреналин, забывая
при этом, что при вазодилятации (артериальной гипотензии), объем кровоток может
быть нормален или даже высок, а соответственно, основная задача гемодинамики
(доставка кислорода тканям) хорошо выполняется. Заметим, что у новорожденных
имеются особенности гемодинамики. Например, Бережанская С.Б. и соавт. (2007)
подчеркивают, что у обследованных ими здоровых детей обнаружена приоритетность
гипокинетического и гиповолемического типов центральной гемодинамики в раннем
неонатальном периоде, обусловленная как высоким периферическим сопротивлением
сосудов, так и уменьшением ОЦК. Поэтому увеличивая сосудистое сопротивление
(например, высокими дозами адреналина), мы чаще всего добиваемся снижения
объемного кровотока и ухудшения перфузии органов. В этом кроется суть второй
ошибки.
Так как объемный кровоток зависит не от одной составляющей
(давление), а от двух (давление и сосудистое сопротивление), то и увеличить его
можно, влияя на обе эти составляющие. Например, повышением артериального
давления или снижением сосудистого сопротивления. Для того чтобы вспомнить, как
это чаще всего происходит в клинической практике, позволим себе небольшую цитату
из книги Зильбера А.П. «Клиническая физиология в анестезиологии и
реаниматологии»: «Выбор пути зависит от конечной цели и применяющихся средств.
Во всяком случае, принцип «цель оправдывает средства» в приложении к
реанимационной ситуации должен быть на последнем месте, поскольку этот принцип
есть свидетельство того, что не мы ведем больного, а патология – нас. Например,
в большинстве клинических ситуаций использование для повышения артериального
давления сосудосуживающих средств, действующих путем увеличения периферического
сопротивления, является неоправданным
и, как правило, вредным». Мы в данном случае сознательно не
заостряем внимание на минутном объеме сердца, помня, что наружная работа сердца
состоит из работы давления и работы объема.
В неонатологии, особенно у глубоконедоношенных, как правило, все
еще чуточку сложнее. Взглянем на рисунок 51.
Что видно на рисунке? Да, извините, внесем необходимые пояснения.
Представлены индивидуальные значения (среднее давление крови и показатели
объемного кровотока в верхней полой вене) у детей в возрасте 5 часов, рожденных
на сроке гестации 27 недель. Исследование выполнено Kluckow M., Evans N.J. из
Австралии в 2000 году.
Из рисунка 51 видно, что между этими показателями возможны как
минимум 4 сочетания.
1 – низкий кровоток и низкое давление, 2 – нормальное давление и
нормальный кровоток,
3 – повышенное давление и сниженный кровоток, 4 – повышенное
давление и нормальный или повышенный кровоток. И действительно, у 19% детей
имелся первый вариант, у 20% –
2 вариант, у 22% – 3 вариант и у 39% глубоконедоношенных
новорожденных – 4 вариант. Таким образом, у большинства детей (при 3 и 4
варианте) вазоконстрикторы категорически противопоказаны, потому что снизят
кровоток и приведут к ишемии органов и тканей.
Вероятно, указанные особенности связаны с выработкой и содержанием
вазоактивных веществ: оксида азота, простагландинов, кининов, эндотелиинов и
т.д.
Конечно, могут быть и другие трактовки указанных
изменений. Например, низкий кровоток + низкое давление = низкий МОС ±
гиповолемия, или просто метаболический ацидоз; повышенное давление + сниженный
кровоток = вазоконстрикция в ответ на низкий МОС ± гиповолемия; повышенное
давление + нормальный или повышенный кровоток = например, нужно увеличить
перфузионное давление в мозге для уравновешения повышенного ВЧД, и т.д.
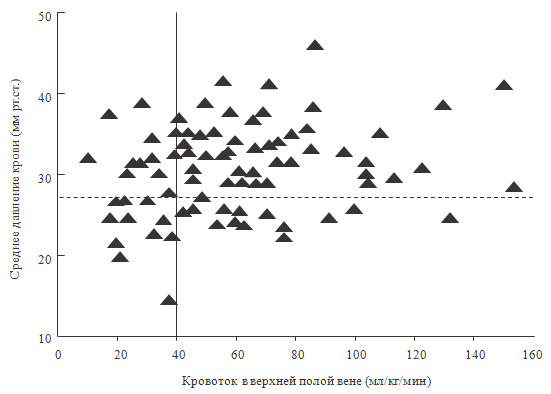
Рисунок 51. Среднее артериальное давление и кровоток в верхней
полой вене у глубоконедоношенных детей (Kluckow M., Evans N.J., 2000)
Тропова Т.Е. и соавт. (2007) показали, что увеличенное содержание
эндотелиина 1 в 5,5 раза по сравнению с доношенными здоровыми детьми отмечается
у 55% недоношенных новорожденных, а активность калликреина у недоношенных в 2,6
выше по сравнению с контролем. Таким образом, это может приводить к снижению АД,
но может не оказывать существенного влияния на кровоток.
Естественно, имеются исследования, посвященные зависимости
мозгового кровотока и артериального давления, т.е. становления ауторегуляции
мозгового кровотока у глубоконедоношенных новорожденных. Именно
глубоконедоношенных, потому что вопрос с доношенными в основном ясен. Мы сами,
занимаясь этой проблемой 20 лет назад (Дюков Э.В., Иванов Д.О.,
1989), показали, что становление ауторегуляции мозгового кровотока
у здоровых новорожденных происходит в первый час жизни, как правило, в первые
15-25 мин. К аналогичным выводам пришли и другие отечественные исследователи (Жетишев
Р.А., 1990; Шабалов Н.П. и соав., 1999; Пальчик А.Б., Шабалов Н.П., 2000).
Позже нашей сотрудницей Зедгенизовой Е.В. (2007) было показано, что
нарушения мозговой гемодинамики у новорожденного определяются неблагоприятными
антенатальными факторами. Она установила, что дети, у матерей которых во время
беременности были выявлены нарушения кровотока в маточных артериях и
среднемозговой артерии плода, начиная с 32-34 недели беременности, в раннем
неонатальном периоде имеют нарушения по типу гипоперфузии. У детей, матери
которых во время беременности имели нарушения кровотока в маточных артериях,
начиная с 20 недели гестации, а с 28 недели – одновременное повышение сосудистой
резистентности в маточных артериях, артериях пуповины и снижение резистентности
в СМА плода, имелись изменения мозгового кровотока по типу ишемии в ранний
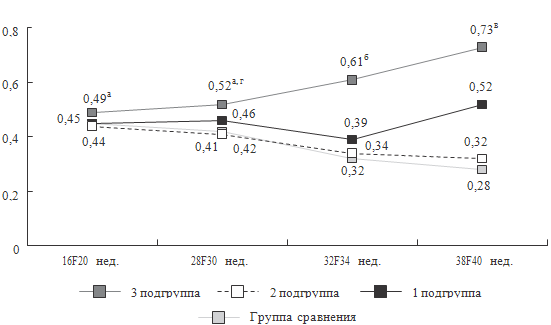
Рисунок 52. Динамика индекса резистентности в маточных артериях у
женщин основной и контрольной группы (здоровые новорожденные) (Зедгенизова Е.В.,
2007)
Примечание.
1-я подгруппа (дети, перенесшие хроническую
внутриутробную гипоксию); 2-я подгруппа (дети, перенесшие острую асфиксию
различной степени тяжести); 3-я подгруппа (дети, перенесшие острую асфиксию на
фоне хронической внутриутробной гипоксии); ра < 0,05 – достоверность различий
с показателями группы сравнения; рб < 0,01 – достоверность различий с
показателями группы сравнения (здоровые дети); рв < 0,001 – достоверность
различий с показателями группы сравнения; рг < 0,05 – достоверность различий с
показателями 1-й подгруппы
неонатальный период. Дети, перенесшие хроническую внутриутробную
гипоксию, имеют церебральную гипоперфузию в ранний неонатальный период, а дети,
перенесшие острую тяжелую и сочетанную асфиксию, имеют церебральную ишемию.
Системная гемодинамика характеризуется снижением насосной функции и
сократительной способности сердца, которые в большей степени проявляются у
детей, перенесших сочетанную гипоксию (см. рисунки 52-53). Таким образом, мы
снова приходим к той мысли, которая была, в принципе, понятна всегда: дело не
столько в качестве реанимационной помощи, а в течение антенатального периода и
здоровья матери. Да, конечно, своевременность и адекватность помощи очень важна,
но дети, попадающие в отделение реанимации, изначально «больные». И главная
проблема неонатологии – проблема профилактики.
Что касается глубоконедоношенных, то результаты исследований
достаточно противоречивы. Например, Tsuji M. et al. (2000), используя
инфракрасную спектроскопию, обнаружил прямую корреляцию между средним АД и
внутримозговой оксигенацией. Однако тогда же (Wardle S.P. et al. 2000)
проведенное исследование у детей, имевших гипотензию, показало, что у них также
оксигенация нейронов достаточная и наличие низкого АД на этот процесс
существенного влияния не оказывает. Munro M. J. et al. (2004),
продемонстрировали, что ауторегуляция мозгового кровотока существует у
нормотензивных глубоконедоношенных детей, нижний предел среднего АД, когда
ауторегуляция еще сохраняется, составляет 30 мм. рт.ст. В более ранних
исследованиях указывалось даже, что артериальная гипотензия приводит к
увеличению количества внутричерепных кровоизлияний у недоношенных (Watkins A.M.
et al., 1989; Bada H.S. et al., 1990). В некоторых катамнестических
исследованиях указывается (Perry E.H. et al., 1990), что перенесенная гипотензия
у недоношенных детей коррелирует с отставанием в психомоторном развитии в 2
года. Однако в недавних исследованиях (Short B.L. et al., 2006) обращают
внимание, что нет убедительных данных о том, что артериальная гипотензия связана
с повышенной летальностью, инвалидизацией, частотой ретинопатий,
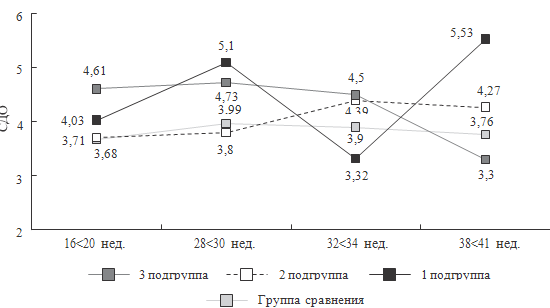
Рисунок 53. Динамика систоло-диастолического отношения в
среднемозговой артерии у плодов основной и контрольной групп (Зедгенизова Е.В.,
2007)
Примечание.
1-я подгруппа – дети, перенесшие хроническую
внутриутробную гипоксию; 2-я подгруппа – дети, перенесшие острую асфиксию
различной степени тяжести; 3-я подгруппа – дети, перенесшие острую асфиксию на
фоне хронической внутриутробной гипоксии.
внутричерепных кровоизлияний и т.д. Вероятно, изначально она
отражает более тяжелое состояние ребенка, возможно, развившееся еще антенатально.
Косвенно это подтверждают данные, полученные Ng P.C. et al. в 2004 году,
обнаруживших высокую специфичность (91%) и прогностическую ценность (82%) низких
базовых сывороточных концентраций кортизола (менее 115 нмоль/л) у
глубоконедоношенных детей с развившейся в последующем глубокой артериальной
гипотензией, а также данные Зедгенизовой Е.В. (2007), приведенные нами выше.
В-третьих, чаще всего наши неонатальные клиники не имеют
возможности измерения центрального венозного давления. Как правило, это приводит
к тому, что венозным давлением просто пренебрегают, почему-то считая его равным
норме (5-8 см вод.ст.). Хотя вклад ЦВД в обеспечение адекватной преднагрузки
сердца будет определять адекватный выброс крови правым желудочком сердца. При
низкой преднагрузке (сниженное ЦВД) невозможно обеспечить увеличение сердечного
выброса и объемного кровотока, что особенно важно при инфекционно-токсическом
или постгеморрагическом шоке.
Недооценка степени преднагрузки (венозная перегрузка правого
желудочка) может быть фатальной: например, острая миокардиальная недостаточность
при тяжелом постгипоксическом синдроме, сопровождающаяся высоким ЦВД.
Необходимо отметить, что имеются исследования, в которых
подвергается сомнению диагностическая ценность измерения центрального венозного
давления и давления заклинивания в системе легочной артерии. Так, Wait F.C.
(2004) на здоровых взрослых добровольцах показал отсутствие корреляции между
преднагрузкой и объемными характеристиками сердечной деятельности. По его
данным, ни ЦВД, ни окклюзионное давление в системе легочной артерии не могут
служить показателями преднагрузки ни ПЖ, ни ЛЖ. По нашему мнению, этот вопрос,
особенно у новорожденных детей в условиях перестройки системной гемодинамики,
нуждается в дальнейшем изучении.
Особую сложность диагностика нарушений гемодинамики в неонатологии
составляет еще и потому, что часто сочетаются с выраженной дыхательной
недостаточностью и переходными состояниями периода новорожденности. Установлено,
что частота артериальной гипотензии увеличивается у детей с экстремально низкой
массой тела. Сразу же оговоримся о физиологическом различии понятий гипотензии и
гиповолемии. У недоношенных со сроком гестации 24 недели частота гипотензии
составляет около 100% (см. рисунок 54).
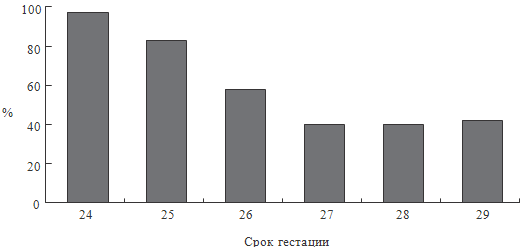
Рисунок 54. Частота артериальной гипотонии в зависимости от срока
гестации (Evans N., 1997)
Dasgupta S.J., Gill A.B. (2003) обнаружили гипотензию у 20% детей с
массой тела менее 1500 г. Хотелось бы обратить внимание, что у
глубоконедоношенных детей гиповолемия очень редко является причиной гипотензии (Dimitriou
G. et al., 2001). Как правило, гиповолемические состояния связаны с потерей
крови, например, фетоплацентарная, фетоматеринская или фетольные трансфузии.
И последнее относящееся к глубоконедоношенным детям, вызывающее еще
большие сложности: определение гипотензии в данной группе детей постоянно
меняются; дискутируются вопрос о ценности и точности методов измерения давления,
особенно неинвазивных; не совсем понятны причины гипотензии в данной группе и ее
прогностическое значение. В связи с этим проводятся исследования, результаты
которых пытаются ответить на указанные вопросы. И один из основных: каков
диапазон колебаний давления, который может рассматриваться как «условная норма»?
Необходимо отметить, что исследований таких достаточно мало, потому что главным
ограничением в их проведении являются технические сложности. Обычно в зарубежной
литературе нормативными данными считаются результаты, полученные в 1981 г.
Versmold H.T. et al.
На рисунке 55 и в таблицах 102-103 представлены результаты
исследования, проведенного Lee J. et al. в 1999 году. Они обследовали 60 детей,
рожденных в сроке гестации 28 недель и менее в течение первых суток жизни.
Давление измерялось у каждого ребенка через каждые 8 мин. Дети не получали препаратов, влияющих на гемодинамику.
Полученные ими результаты показателей среднего АД ниже, чем те,
которые получили Versmold H.T. et al. (см. таблицу 102). Авторы заключают, что,
вероятно, глубоконедоношенные дети могут иметь более низкие величины среднего
АД, чем можно ожидать, и это не требует терапии, если ребенок не имеет
клинической симптоматики гипоперфузии, таких как удлинение «симптома белого
пятна», олигурии или метаболического ацидоза. Введение коллоидов или
кристаллоидов в такой ситуации может привести к перегрузке объемом и развитию
острой сердечной недостаточности.
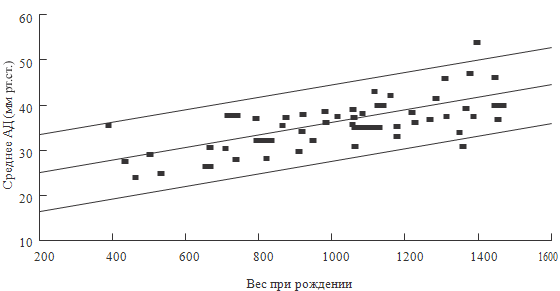
Рисунок 55. Среднее артериальное давление у недоношенных детей (Lee
J. et al., 1999)
Таблица 102. Среднее артериальное давление у детей в зависимости от
веса при рождении (Lee J. et al., 1999)
|
Вес при рожденииг)
|
500 |
600 |
700 |
800 |
900 |
1000 |
1100 |
1200 |
1300 |
1400 |
1500 |
|
среднее АД
|
|
0-12 ч жизни |
20 |
21 |
22 |
23 |
24 |
26 |
27 |
28 |
29 |
30 |
31 |
|
Данные Versmold H.T. et al.
(1981) |
- |
(24) |
(24) |
(25) |
(25) |
(26) |
(26) |
(27) |
(27) |
(28) |
(28) |
|
13-24 ч жизни |
21 |
22 |
23 |
25 |
26 |
28 |
29 |
30 |
32 |
33 |
34 |
Таблица 103. Среднее артериальное давление у детей в зависимости от
срока гестации (Lee J. et al., 1999)
|
Срок гестации (нед.) |
23 |
24 |
25 |
26 |
27 |
28 |
29 |
30 |
31 |
32 |
33 |
34 |
35 |
|
Среднее артериальное давление (мм рт.ст.)
|
|
0-12 ч жизни |
20 |
21 |
22 |
23 |
25 |
26 |
27 |
28 |
29 |
30 |
31 |
32 |
33 |
|
13-24 ч жизни |
20 |
22 |
23 |
25 |
27 |
28 |
29 |
30 |
32 |
33 |
35 |
36 |
37 |
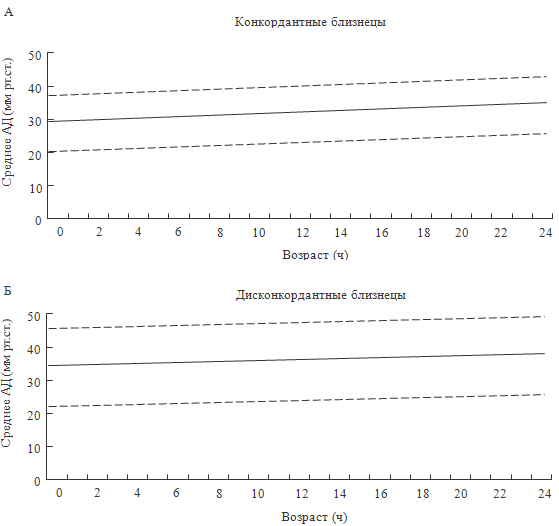
Рисунок 56. Величины среднего артериального давления у близнецов (Cordero L., Johnson J.R., 2002)
Подводя итог, они определяют нормальные величины среднего АД как 10
перцентиль от цифры, равной гестационному возрасту, выраженному в неделях, а
гипотензию как снижение среднего артериального менее этой цифры. Эти данные
согласуются и с мнением других исследователей (Nuntnarumit P. et al., 1999;
Dasgupta S.J., Gill A.B., 2003).
Как известно, достаточно часто недоношенными рождаются дети от
многоплодной беременности. Cordero L., Johnson J.R. (2002) обследовали
конкордатных и дискордантных близнецов, родившихся с экстремально низкой массой
тела, для установления нормативных величин среднего артериального давления.
Оказалось, что они отличаются. Дискордантные близнецы имели более высокие
показатели среднего АД в течение первых суток жизни. Авторы не уточняют, с чем
связаны эти различия, но, на наш взгляд, они могут быть связаны с большей
частотой трансфузий у дискордантных близнецов (рисунок 56).
Интересно, что исследуя гемодинамические нарушения у близнецов в
раннем неонатальном периоде, отечественные исследователи Черданцева Г.А.,
Ярыгина И.В. (2007) также обнаружили различия у конкордантных и дискордантных.
Оказалось, что у близнецов достаточно часто встречаются нарушения инотропной и
насосной функции сердца, но в группе конкордантных близнецов выявленные
нарушения носили более выраженный и стойкий характер.
Что касается методов регистрации, то наиболее оптимальным считается
прямое измерение давления через пупочный или периферический артериальный
катетер. Хотя имеются исследования (Weindling A.M., 1989) в которых
подчеркивается, что если размер манжеты стандартизирован и подобран правильно,
то неинвазивные методы измерения не уступают в точности инвазивным. Но по нашим
наблюдениям, никакая кратность повторений NIBP не заменяет контроля АД в режиме
реального времени.
Еще один немаловажный вопрос: последствия перенесенного заболевания
и гипотензия в неонатальный период не является исключением. Fanaroff J.M. et al.
(2006) исследовали отдаленное влияние перенесенной гипотензии у
глубоконедоношенных детей, родившихся с массой тела менее 1000 г. Было выделено
две группы детей, имевших гипотензию: первая – которым ее лечили и вторая –
которым ее не лечили. Группы были сравнимы по всем параметрам: весу, сроку
гестации, факторам риска и т.д. вторую группу составили дети, имевшие гипотензию
в течение первых 72 часов жизни и для ее коррекции получавшие парентеральное
введение жидкости, инотропы, кортикостероиды или их сочетание. Был проведен
подробный математический анализ. В последующем все дети обследованы в возрасте
20 месяцев. И вот что получилось (см. таблицы 104-105).
Таблица 104. Неонатальная заболеваемость/смертность при
неонатальной гипотензии (Fanaroff J.M. et al., 2006)
|
Показатель
|
Лечили гипотензию
(n = 59)
|
Никогда не получали антигипотензивн. лечения (n = 97) |
р
|
|
Сепсис с положительным посевом крови (%) |
64
|
47
|
0,116
|
|
Некротический энтероколит (%) |
7,7
|
8,9
|
1000
|
|
ОАП (%) |
62
|
47
|
0,191
|
|
Все перивентрикулярные кровоизлияния (%) |
20,5
|
22,8
|
0,964
|
|
Интравентрикулярные кровоизлияния III-IV степени (%) |
19
|
2
|
0,016
|
|
ПВЛ (%) |
2,6
|
2,5
|
1000
|
|
Койко-день (среднее и разброс) |
106 (52-187)
|
89 (35-194)
|
0,002
|
|
Смертность (%) |
34
|
16
|
0,013
|
Таблица 105. Отдаленные неврологические результаты (Fanaroff J.M.
et al., 2006)
|
Показатель
|
Лечили гипотензию
|
Никогда не получали антигипотензивного лечения
|
р
|
|
Оценка моторных навыков по шкале Балей в 20 месяцев |
69,9±15,3
|
77,1 ± 16,7
|
0,035
|
|
Оценка умственных способностей по шкале Балей в 20 месяцев |
74±15
|
78 ± 15
|
0,220
|
|
Церебральный паралич (%) |
10
|
7
|
0,565
|
|
Глухота (одноили двусторонняя) (%) |
10,3
|
1,3
|
0,045
|
Из таблиц видно: дети, получавшие антигипотензивную терапию как в
неонатальном периоде, так и возрасте 20 месяцев, отличались от тех, которые
терапию не получали. Отличались, прямо скажем, в худшую сторону. Они реже
выживали, дольше находились в стационаре, имели больше неврологических
осложнений и т.д. Правда, в первые 72 часа жизни они имели более низкие цифры АД
(рисунок 57). Вероятно, именно этот клинический факт и побудил врачей назначить
им терапию. Возможно, тяжесть состояния больных в группе I была больше, чем в
группе II, и данные больные потребовали терапии.
Но что привело к тому, что показатели давления у них были ниже?
Вроде бы группы стратифицированы по большинству показателей.
И математический анализ показал любопытный и значимый факт,
отличающий группы: антенатальное применение стероидов в группе детей, не
нуждающихся в препаратах, устраняющих гипотензию. На наш взгляд, на примере этой
работы мы снова сталкиваемся с двумя важнейшими вопросами медицины: во-первых,
терапия, проводимая нами, может повредить, во всяком случае, полученные
результаты позволяют это предполагать. А во-вторых, профилактировать безопаснее
и легче, чем лечить. (Да, чуть не забыли, поскольку в современной России все
стало товаром, в том числе и здоровье, укажем еще один результат – дешевле). Как
профилактировать нарушения гемодинамики у глубоконедоношенных? Современная
перинатология знает ответ на этот вопрос. В последние 10-15 лет многие
исследователи (Moise A.A. et al., 1995; Osborn D.A. et al., 2003), настойчиво
указывают на необходимость профилактики гемодинамических расстройств у
недоношенных детей. И лучшим способом считается антенатальная стероидная
терапия. Установлено, что в последующем после ее проведения у недоношенных
отмечается более высокое среднее артериальное давление, они имеют меньшие
потребности в инотропах, у них реже развиваются нарушения мозгового кровотока,
они чаще выживают, требуют менее длительной ИВЛ. Много положительных эффектов,
хотя, на наш взгляд, достаточно одного, чтобы внедрить ее в целом по России. Для
доказательства возьмем хотя бы один эффект, ну, пусть вот этот – снижение
продолжительности ИВЛ. Оказывается, что увеличение пребывания ребенка на ИВЛ
каждые 10 дней увеличивает риск развития ДЦП на 20% (Laptook A.R. et al., 2005).
Работ, посвященных антенатальному применению кортикостероидов, в
нашей стране не так много, и они достаточно противоречивы. Возможно, это
обстоятельство обусловлено различными методологическими подходами. Например,
Логвинова И.И. и соавт. (2002) указывает, что проведение антенатальных курсов
стероидов повышает выживаемость недоношенных детей, но при этом оказывается
частота асфиксии, СДР, ВЖК, длительность проведения ИВЛ не отличались в группах
детей, получавших и не получавших стероиды, а частота интранатальных повреждений
позвоночника была даже выше у детей, дексаметазон не получавших. А что тогда
обусловило лучшую выживаемость?
Вопрос о повышенном давлении и гиперперфузии (хотя это также не
одно и то же) чрезвычайно интересен и непрост. Так, нами (Зедгенизова Е.В.,
Иванов Д.О., 2007) было установлено, что наиболее неблагоприятные исходы
перенесенной асфиксии новорожденных к концу первого года жизни наблюдались у
детей, имевших в раннем неонатальном периоде нарушения
церебральной гемодинамики по типу гиперперфузии (ишемии).
Количество неблагоприятных исходов составило 27,7%, в то время как у детей с
гипоперфузией головного мозга в ранний неонатальный период – 15,3%. Вероятно,
связано это с тем, что на определенном этапе заболевания гиперперфузия
отображает известный феномен, описанный Неговским В.А. с соавт. (1987) под
названием «постреанимационная болезнь». В данной трактовке мы исходим из того,
что ребенок, перенесший асфиксию, потребовавшую проведения реанимационных
мероприятий, всегда имеет отек головного мозга той или иной степени. И
зарегистрированная нами гиперперфузия отражает тяжесть отека головного мозга и
внутричерепной гипертензии, при которых организм пытается повышенным кровотоком
и САД «продавить» кровь к ишемизированным участкам мозга и компенсировать
высокое ВЧД.
Этот вопрос, на наш взгляд, должен привлекать очень пристальное
внимание детских врачей, независимо от узкой специализации – неонатологов,
педиатров, реаниматологов и т.д., потому что имеются данные (Воронцов И.М. и
соавт., 2006; Абдрахманов К.Б. и соавт., 2007), позволяющие утверждать, что
нарушения АД в неонатальный период отражают нарушения регуляции АД,
сохраняющиеся на всю оставшуюся жизнь и приводящие в отдаленные периоды к
развитию артериальной гипертензии и повышенной смертности от ее осложнений
(инсультов, инфарктов).
Особенно это актуально для нашей страны, имеющей смертность по
заболеваниям сосудистой системы у детей, по данным, приводимым Воронцовым И.М. и
соавт. (2006) (см. приложение 15), в 1,5-2,0 раза больше, чем во многих странах
мира. Как указывают авторы: «Также ведут себя и уровни смертности в самой
младшей возрастной группе детей, как мальчиков, так и девочек. Можно
предположить и существенное нарастание патологии сосудистой системы, и
отсутствие ресурсов для противостояния этому нарастанию в России».
Эпидемиологические исследования последних лет (Почивалов А.В. и соавт., 2007)
указывают на отклонения АД от нормальных величин у 39% подростков. Анализ
факторов риска развития
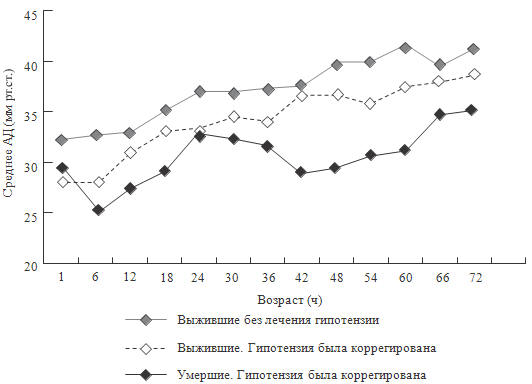
Рисунок 57. Показатели среднего АД у глубоконедоношенных детей в
первые 72 часа жизни (Fanaroff J.M. et al., 2006)
сердечно-сосудистых заболеваний показывает значимую роль
наследственной отягощенности (86%) и неблагоприятный акушерско-гинекологический
анамнез у матери (75% детей). Замыкается «порочный круг». И последнее звено –
рождение детей женщинами, имеющими кардиоваскулярную патологию (КВП). Таболин
В.А. и соавт. (2007) показали, что увеличивается количество детей, умерших в
перинатальном периоде у женщин с КВП с 3,6‰ в 2003 году до 10,8‰ в 2005 году.
Удельный вес детей (от всех умерших в перинатальном периоде) у женщин с КВП
вырос от 14,8 до 80%. При этом количество недоношенных детей, рожденных
женщинами с КВП, из общего числа недоношенных новорожденных возрастало,
составляя от 52% в 2003 году до 79% в 2005 году. Показатели летальности у
недоношенных, родившихся у женщин с КВП, не изменялись (1,6% в 2003 г. и 1,7% в
2005 г.), в то время как показатели летальности недоношенных у женщин без КВП
уменьшились в 2 раза (3,9 и 1,7%).
Конечно, мы не можем изменить наследственных наших пациентов.
Понятно (Глотов А.С. и соавт., 2007), что наличие определенного полиморфизма в
генах ренин-ангиотензиновой и кинин-брадикининовой систем играют важную роль в
развитии артериальной гипертензии. Но чаще всего для развития заболевания
наследственной предрасположенности мало, необходимо влияние экзогенных факторов.
И не хотелось бы, чтобы одним из этих экзогенных факторов была проводимая нами
терапия.
По нашим данным (Иванов Д.О., 2002), нарушения гемодинамики и
гиповолемия особенно часто сопровождают инфекционную патологию у новорожденных
(см. таблицу 106).
Таблица 106. Частота нарушений гемодинамики у детей с различными
формами инфекционного процесса в разгар заболевания (Иванов Д.О., 2002)
|
Признак
|
Сепсис
|
Пневмония |
|
срок гестации ≥ 32 недель
|
|
доношенные
|
масса 1500-2500 г
|
|
А*
|
Б*
|
А*
|
Б*
|
|
n = 31
|
n = 55
|
n = 22
|
n = 29
|
n = 62 |
|
% детей, имеющих данный признак
|
|
Гипотензия ≤ 55 мм рт.ст. |
76,8 2
|
64,8
|
78,2 2
|
68,0
|
41,6
|
|
Гипотензия ≤ 50 мм рт.ст. |
48,01, 2
|
28,0
|
54,51, 2
|
34,0 3
|
17,7
|
|
Гипертензия ≥ 100 мм рт.ст. |
48,01, 2
|
23,4 3
|
54,51, 2
|
31,0 3
|
6,4
|
|
Брадикардия |
32,7 2
|
25,2 3
|
27,6 2
|
17,0
|
11,2
|
|
Тахикардия |
67,2
|
72,0
|
77,0
|
78,2
|
57,6
|
|
Дефицит ОЦК > 25% |
34,01, 2
|
14,4 3
|
77,01, 2
|
31,0 3
|
3,2
|
|
Дефицит ОЦК > 30% |
24,0 2
|
23,4 3
|
36,8 2
|
31,0 3
|
0,0
|
|
Дефицит ОЦК > 35% |
9,9 2
|
10,8 3
|
18,4 2
|
20,4 3
|
0,0
|
|
Олигурия |
86,41, 2
|
63,0 3
|
87,4 2
|
71,4 3
|
38,4
|
Примечание. А* – гипоэргический вариант сепсиса. Б* –
гиперэргический вариант сепсиса. 1 – р < 0,05 – между вариантом А и вариантом
Б; 2 – р < 0,05 между вариантом А сепсиса и пневмонией; 3 – р <0,05 между
вариантом Б и пневмонией.
Как известно, главным принципом диагностики гемодинамических
нарушений и гиповолемии должна быть комплексная оценка клинических, мониторных и
лабораторных показателей.
Для объективной оценки состояния кровообращения и диагностики
гиповолемии у новорожденных наряду с клиническими признаками, свидетельствующими
об адекватности или неадекватности тканевого кровотока (темп диуреза, симптом
«белого пятна»), необходимо использовать мониторинг таких показателей
гемодинамики, как АД, ЦВД, ЧСС, измерение ОЦК с помощью индикатора дефицита
циркулирующей крови, регистрация капиллярного кровотока.
К постановке диагноза гиповолемии следует подходить с большой
осторожностью, потому что и недооценка нарушений гемодинамики, так и излишняя
активность и агрессивность врача в терапии может вызывать трудно курабельные
нарушения. Для оценки системной гемодинамики в практической работе полезно
ориентироваться на цифры артериального давления у новорожденных в первые 12
часов жизни, в зависимости от массы тела (см. приложение 8). Что касается
глубоконедоношенных, то они приведены выше (таблицы 102, 103, рисунок 55).
Для оценки патогенеза расстройств гемодинамики у конкретного
больного следует указать на отдельные факторы, приводящие к критическому
уменьшению тканевого кровотока у новорожденного ребенка (Меньшугин И.Н., 1993, с
изменениями):
Снижение кровотока из-за недостаточного притока к правому
предсердию:
а) гиповолемические состояния (патологические потери жидкостей
организма, кровопотеря, фето-плацентарная и фето-фетальная трансфузия, разрыв
сосудов пуповины);
б) патологическая текучесть капилляров (секвестрация жидкости в
тканях):
– гидростатический компонент (при повышенном ЦВД или гиперволемии).
Обращаем внимание на нетождественность данных понятий;
– гипопротеинемический компонент (становится значимым при общем
белке сыворотки крови < 45 г/л;
– воспалительно-трофический компонент (каскад цепных
воспалительных реакций → прилипание активированных лейкоцитов и тромбоцитов к
эндотелию сосудов микроциркуляторного русла → выделение лейкотриенов,
тромбоксанов, протеолитических ферментов, свободных радикалов);
– лимфатический компонент (нарушение оттока лимфы будет влиять на
вышеуказанные факторы).
Недостаточность периферического кровотока из-за нарушения
сосудистого тонуса:
– повышение сосудистого тонуса (I фаза шока, медикаментозные
препараты, термическая травма (охлаждение) и т.д.);
– понижение сосудистого тонуса (II фаза шока, медикаментозные
препараты, термическая травма (перегрев), снижение чувствительности
адренорецепторов к эндогенным катехоламинам, глубокая кома и т.д.).
Снижение периферического кровотока из-за недостаточного
сердечного выброса:
– снижение диастолического наполнения желудочков из-за уменьшения
венозного возврата крови к сердцу;
– снижение сократительной функции миокарда;
– нарушение коронарного кровотока при низком артериальном
давлении;
– нарушение ритма и частоты сердечных сокращений (брадикардии или
тахикардии, нарушение координации в сокращении предсердий и желудочков);
– тампонада перикарда;
– высокая постнагрузка при артериальной и легочной гипертензии,
сужении магистральных сосудов, клапанном и подклапанном стенозе аорты;
– перегрузка «объемом» при септальных дефектах, сосудистых
шунтах, недостаточности клапанов с регургитацией.
Имеется несколько общих патофизиологических моментов, характерных
для всех видов
нарушений центральной и периферической гемодинамики:
1. Дефицит ОЦК, абсолютный или относительный, сочетающийся с
первичным или вторичным поражением сердца и с повышением периферического
сосудистого сопротивления за счет гиперкатехоламинемии. Возникает так называемый
«большой гемодинамический самоухудшающийся круг».
2. Главными стимуляторами выделения катехоламинов являются
гиповолемия, гипоксия, лактат-ацидоз и т.д. Особенно большое значение для
дальнейшего ухудшения состояния
больного имеет несвоевременная коррекция указанных нарушений,
вызывающих за счет централизации кровообращения обеднение периферического
тканевого кровотока.
3. Реологические расстройства в области микроциркуляции
представляют собой главное патологическое явление при нарушении гемодинамики.
При этом происходит нарушение снабжения клеток энергией и другими необходимыми
веществами для жизнедеятельности.
4. Прогрессирующий ацидоз достигает критической точки. Прекращается
жизнедеятельность клеток, что приводит к появлению очагов некроза.
5. Тканевая гипоксия приводит к недостаточности энергогенеза.
Возникает сердечная недостаточность как частный случай энергодинамической
недостаточности.
6. Артериальная гипотензия как симптом имеет второстепенное
значение (при нормальных цифрах АД может быть резко нарушена тканевая перфузия
из-за выраженной вазоконстрикции). По нашим наблюдениям, лучше иметь дело с
пониженным АД, если обеспечена удовлетворительная тканевая перфузия.
Таким образом, относительная или абсолютная гиповолемия будет
непременным спутником нарушений центральной и периферической гемодинамики.
Для клинической картины гиповолемии характерны следующие
клинические и лабораторные признаки:
• акроцианоз, бледность, «мраморный рисунок» кожных покровов;
• симптом «белого пятна» более 3 секунд;
• холодные дистальные отделы конечностей;
• общая гипотермия;
• синдром угнетения ЦНС с выраженностью до комы;
• при аускультации сердца определяются тахикардия и глухость
сердечных тонов;
• пульс на периферических артериях либо не определяется, либо
малого наполнения;
• диурез снижен (менее 0,5 мл/кг/ч в первые сутки жизни или менее 1,0
мл/кг/ч в последующие);
• системное АД снижено, однако АД может быть снижено умеренно
из-за увеличения
ОПСС и централизации кровообращения (нормальные показатели АД для
новорожденных детей представлена в приложении 8);
• ЦВД < 4 см вод.ст. (1 см вод.ст. = 0,74 мм рт.ст.) (ЦВД
измеряется через катетер с внутренним диаметром не менее 1 мм, заведенный в нижнюю полую вену
через пупочную вену до уровня 1-2 см выше диафрагмы или катетер, заведенный в
бедренную, подключичную, яремную вены; норма ЦВД – 4-6 мм рт.ст. или 5-8 см
вод.ст.);
• снижение капиллярного кровотока;
• метаболический ацидоз;
• снижение ОЦК.
Хотелось бы заострить внимание врачей на измерении «симптома белого
пятна» или времени капиллярного наполнения, одного из важнейших критериев
гиповолемии. Хоть он эмпирически описан очень давно, но работы, посвященные его
диагностической ценности, измеряются единицами. В русскоязычной литературе нам
таковых вообще не встретилось. В зарубежной они есть. Есть даже такие, в которых
ценность данного метода подвергается сомнению (Saavedra J.M. et al., 1991;
Gorelick M.H. et al., 1993). Эти сомнения привели к тому, что в 1997 году
Strozik K.S. et al. провели исследование, посвященное данному вопросу у
новорожденных детей. Они одновременно фиксировали время наполнения капилляров с
помощью электронно-лучевого микроскопа и «симптом белого пятна» с помощью
секундомера. Оказалось, что данные, полученными обеими методами, практически
совпадают. Симптом
«белого пятна» имеет высокую диагностическую ценность и не зависит
от пола, срока гестации, от некоторых видов терапии и т.д. (см. таблицу 107).
Наиболее лучшими и точными участками для измерения, по их данным, является
середина грудины и середина лба. Кстати, у детей более старшего возраста (с 14
суток жизни), нормальные величины «симптома белого пятна» – не более 2 секунд (Schringer D.L., Baraff L.J.,
1988). Так что, уважаемые коллеги, давайте не будем забывать при осмотре больных
пользоваться таким простым и точным способом диагностики гиповолемических
состояний.
Таблица 107. Время наполнения капилляров у новорожденных детей (Strozik
K.S. et al., 1997)
|
Показатель
|
Среднее (SD) грудная клетка
(с)
|
р value |
Среднее (SD)
голова
(с)
|
р value
|
|
Фототерапия: |
|
НР
|
|
0.02
|
|
не получавшие (n = 384) |
1,89 (0,37)
|
|
1,75 (0,38)
|
|
|
получавшие (n = 85) |
1,91 (0,43)
|
|
1,65 (0,42)
|
|
|
Выхаживался в: |
|
0,0075
|
|
0.0001
|
|
кювезе (n = 81) |
2,01 (0,42)
|
|
1,62 (0,41)
|
|
|
столик с обогревом (n = 78) |
1,83 (0,45)
|
|
1,59 (0,36)
|
|
|
кроватка (n = 310) |
1,88 (0,35)
|
|
1,79 (0,35)
|
|
|
Способ родоразрешения: |
|
0,002
|
|
НР
|
|
кесарево сечение |
1,95 (0,42)
|
|
1,72 (0,41)
|
|
|
естественные род. пути |
1,84 (0,31)
|
|
1,74 (0,30)
|
|
|
Пол: |
|
НР
|
|
НР
|
|
мальчики |
1,89 (0,38)
|
|
1,71 (0,34)
|
|
|
девочки |
1,90 (0,38)
|
|
1,74 (0,40)
|
|
|
Вес при рождении: |
|
НР
|
|
НР
|
|
< 2500 г (n = 169) |
2,00 (0,35)
|
|
1,69 (0,34)
|
|
|
> 2500 г (n = 300) |
1,84 (0,41)
|
|
1,76 (0,41)
|
|
|
Срок гестации: |
|
НР
|
|
НР
|
|
< 37 недель (n = 203) |
1,98 (0,41)
|
|
1,72 (0,41)
|
|
|
> 38 недель (n = 266) |
1,82 (0,34)
|
|
1,73 (0,34)
|
|
|
Соотношение массы к гестационному сроку: |
|
НР
|
|
НР
|
|
адекватное (n = 317) |
1,90 (0,39)
|
|
1,74 (0,37)
|
|
|
ЗВУР (n = 95) |
1,93 (0,38)
|
|
1,60 (0,38)
|
|
|
крупные к сроку (n = 57) |
1,84 (0,34)
|
|
1,83 (0,31)
|
|
|
Всего (n = 469) |
1,90 (0,38)
|
|
1,73 (0,37)
|
|
Примечание. НР – нет различий.
Существуют и более сложные методы оценки микроциркуляции, но, к
сожалению, для их проведения и интерпретации нужна соответствующая аппаратура и
условия. Их достаточно сложно применить в рутинной клинической практике.
Например, Степанова Н.А. и соавт. (2005) для исследования микроциркуляции
использовали неинвазивную биомикроскопию микрососудов конъюктивы глаза с
обработкой на ЭВМ. Исследование выполнено на детях более старшего возраста, но,
вероятно, методика может быть использована и у новорожденных. В частности, им
удалось показать, что степень интоксикации, ее длительность и т.д. четко
коррелирует с изменениями микроциркуляции, которые можно охарактеризовать не
только количественно, но и качественно. Они также показали, что изменения
хемотаксической активности макрофагов отражают ни только степень и длительность
интоксикации, но и связаны с выраженностью микроциркуляторных расстройств.
Конечно, в клинической практике очень важно выделить ранние
симптомы гиповолемии, определить значимость отдельных симптомов и их сочетания,
а также чувствительность и специфичность каждого из них. И такая работа была
проделана Gorelick M.H. et al. в 1997 году. Они на большом клиническом материале
по указанным критериям проанализировали признаки, рекомендованные экспертами ВОЗ
(Practice parameter: the management of acute gastroenteritis in young children,
1996) как симптомы гиповолемии (см. таблицу 108) с целью выявления наиболее
ранних и значимых. Основные результаты их работы представлены в таблицах
109-110.
Таблица 108. Признаки гиповолемии у маленьких детей (Practice
parameter: the management of acute gastroenteritis in young children, 1996)
|
Признаки и симптомы
|
Степень дегидратации
|
|
нет или легкая
|
умеренная
|
тяжелая
|
|
общее состояние |
грудные дети |
жажда, беспокойство |
сонливость, вялость |
«обмякший»; холодные, цианотичные конечности; может быть кома |
|
старшие дети |
жажда, беспокойство |
вялость, головокружение после перемены положения тела |
чувство страха; холодные цианотичные конечности, судороги мышц |
|
Пульс на a. radialis |
нормальный |
слабый
или нитевидный |
нечеткий или неопределяемый |
|
Дыхание |
нормальное |
глубокое |
глубокое и частое |
|
Тургор кожи |
складка расправляется немедленно |
складка расправляется медленно |
складка расправляется очень медленно (более 2 с) |
|
Глаза |
нормальные |
запавшие |
очень запавшие |
|
Слезы |
есть |
нет |
нет |
|
Слизистые |
влажные |
сухие |
очень сухие |
|
Диурез |
нормальный |
снижен |
нет мочи в течение многих часов |
Таблица 109. Диагностическое значение клинических симптомов (Gorelick
M.H. et al., 1997)
|
симптом
|
Частота |
Чувствительность
(95% CI)
|
Специфичность
(95% CI)
|
|
Снижение тургора кожи |
0,14
|
0,35 (0,23, 0,49)
|
0,97 (0,92, 0,99)
|
|
Заполнение капилляров > 2 с |
0,19
|
0,48 (0,35, 0,61)
|
0,96 (0,90, 0,99)
|
|
Общий вид |
0,26
|
0,59 (0,46, 0,71)
|
0,91 (0,84, 0,95)
|
|
Отсутствие слез |
0,30
|
0,67 (0,53, 0,78)
|
0,89 (0,82, 0,94)
|
|
Изменения дыхания |
0,20
|
0,43 (0,30, 0,56)
|
0,86 (0,78, 0,91)
|
|
Сухие слизистые |
0,42
|
0,80 (0,67, 0,89)
|
0,78 (0,70, 0,85)
|
|
Запавшие глаза |
0,31
|
0,60 (0,47, 0,72)
|
0,84 (0,76, 0,90)
|
|
Аномальный пульс на периферии |
0,24
|
0,43 (0,30, 0,56)
|
0,86 (0,78, 0,91)
|
|
Тахикардия (ЧСС) > 150 |
0,24
|
0,46 (0,32, 0,61)
|
0,79 (0,72, 0,87)
|
|
Снижение диуреза |
0,59
|
0,85 (0,73, 0,93)
|
0,53 (0,44, 0,62)
|
В заключение они указывают, что полученные ими результаты
отличаются от рекомендованных экспертами ВОЗ. По их мнению, гиповолемию можно
диагностировать гораздо раньше. Так, наличие двух симптомов у ребенка уже
соответствует потере жидкости менее 5%, если у ребенка есть 3 или более
симптома, то дефицит составляет от 5% до 10%. Чувствительность = 87%, а
специфичность = 82%.
Таблица 110. Коэффициент регрессии факторов, ассоциированных с
дегидратацией (Gorelick M. H. et al., 1997)
|
Признак
|
Коэффициент
|
р
|
|
Заполнение капилляров > 2 с |
2,5859
|
0,0002
|
|
Сухие слизистые |
1,4572
|
0,0079
|
|
Отсутствие слез |
1,4492
|
0,0077
|
|
Общий вид |
1,1079
|
0,0427
|
Наиболее ранними признаки гиповолемии, выявленными с помощью
математического анализа (заметим, что это подтверждено огромным количеством
клинических наблюдений), даже когда дефицит менее 5%, являются удлинение
симптома «белого пятна», сухость кожных покровов и слизистых, отсутствие слез.
Duggan E. et al. (2003) также предложившие шкалу для оценки
тяжести гипернатриемиче-
ской дегидратации (см. таблицу 111), обращают внимание, что процент
потери массы тела при
различных степенях дегидратации сильно различается у разных
авторов. При интерпретации показателей должны учитываться только критические
факторы, позволяющие оценить гемодинамический статус пациента и уровень
перфузии. Если врач не может точно определиться со степенью дегидратации, то
рекомендуется проводить лечение, соответствующее более тяжелой степени
дегидратации.
Таблица 111. Оценка степени дегидратации (Duggan E. et al., 2003)
|
Параметр
|
Легкая (3-5%)
|
Умеренная (6-9%)
|
Тяжелая (≥ 10%)
|
|
АД |
норма |
норма |
снижено |
|
Свойства пульса |
норма |
норма или незначительно ослаблен |
умеренно ослаблен |
|
ЧСС |
норма |
тахикардия |
тахикардия (в тяжелых случаях может быть брадикардия) |
|
Тургор кожи |
норма |
снижен |
снижен |
|
Родничок |
норма |
запавший |
запавший |
|
Слизистые |
слегка сухие или норма |
сухие |
сухие |
|
Глаза |
норма |
запавшие |
сильно запавшие |
|
Конечности |
теплые, нормальное время заполнения каппиляров |
замедлено время заполнения каппиляров |
холодные, мраморные |
|
Сознание |
норма |
вялость, апатия |
летаргия, кома |
|
Диурез |
незначительно снижен |
менее 1 мл/кг/ч |
значительно меньше 1 мл/кг/ч |
|
Жажда |
выраженная незначительно |
умеренно выражена |
очень сильная жажда (если сознание ребенка позволяет ее
оценить) |
При относительной гиповолемии симптоматика зависит от основного
заболевания. Общим правилом является длительная клиническая компенсация.
Например, возможно сочетание отечного синдрома с гиповолемией при
генерализованных бактериальных инфекциях.
Для простоты решения вопроса об этиологии гиповолемии рекомендуем
таблицу, основанную на ведущем нарушении параметров центральной гемодинамики при
I фазе шока.
Параметры центральной гемодинамики: ОЦК, АД, ЧСС, ЦВД при различных видах шока
|
Вид / параметры
|
ОЦК
|
АД
|
ЦВД
|
ЧСС
|
|
Гиповолемический |
↓
|
↑
|
↓
|
↑
|
|
Кардиогенный |
N
|
↑
|
↑
|
N или ↓
|
|
Септический
(А-В шунт) |
N
|
↓
|
N или ↓ |
↑
|
|
Анафилактический
Тонуса прекапилляров ↓ |
N
|
↓
|
N или ↓ |
↑
|
Òåðàïèÿ ãåìîäèíàìè÷åñêèõ íàðóøåíèé ó íîâîðîæäåííûõ
äåòåé
Нарушения тканевой перфузии у новорожденных детей требуют активной
терапии, так как длительная гипоперфузия внутренних органов (более 2 часов)
может приводить к возникновению значимых органных поражений. При подготовке к
транспортировке новорожденного крайне важно выявить факторы, вызвавшие
недостаточность кровообращения, для выбора приоритетов терапии (внутривенная
инфузия, инотропная поддержка, гормонотерапия и т.д.).
Последовательность основных мероприятий, направленных на
восстановление адекватного кровообращения у новорожденного ребенка:
1. Оценка состояния больного с выделением ведущего фактора,
обуславливающего недостаточность кровообращения. При наличии данных за наличие
шока – противошоковая терапия.
2. Устранение гипоксемии, ацидоза, гипотермии.
3. Обеспечение оптимального уровня глюкозы крови.
4. Обеспечение оптимального уровня гемоглобина и гематокрита.
Основные этапы устранения гемодинамических нарушений
Инфузионная терапия (объемом) будет являться основным методом
лечения гемодинамических нарушений при наличии положительного ответа на
проводимую терапию в виде повышения артериального давления. В случае отсутствия
такого ответа основное место в терапии будет занимать инотропная поддержка.
Расчет объема инфузионной терапии будет зависеть от степени
артериальной гипотензии (см. таблицу 112).
Таблица 112. Расчет величины стартового объема инфузионной терапии
(Меньшугин И.Н., 1993)
|
Степень гипотензии |
Среднее АД
(в % от возрастной нормы) |
Стартовый объем
(мл/кг/ч)
|
Темп введения
|
|
I
|
70-80
|
10-15
|
50% расчетной дозы вводится в первые 15 мин, оставшиеся
50 % – за 45 мин |
|
II
|
60-69
|
15-25
|
|
III
|
< 60
|
25-35
|
В практической работе чаще всего используется расчет, основанный на
эмпирических данных (Шабалов Н.П., 2006; Farris B.L. et al., 2002). Вводится
физиологический раствор (при гематокрите более 35%) из расчета 10 мл/кг в
течение 10-20 мин. Если же гематокрит менее
35%, то больному должна быть перелита одногруппная эритроцитная
масса 5-10 мл/кг в течение 30-40 мин.
При введении стартового объема инфузионной терапии через 1 час
после введения должна быть произведена оценка показателей центральной
гемодинамики. Известны 4 возможных типа реакций центральной гемодинамики (Меньшугин
И.Н., 1993, с изменениями):
1. АД – нормализация; ЦВД – нормализация (вероятно, имела место
гиповолемия; нагрузка объемом быстро снижается; переход на поддерживающую
инфузию; нет показаний для назначения инотропных препаратов);
2. АД – нормализация; ЦВД – повышение выше нормы или его прирост >
6,5 см вод. ст. (объем инфузионной терапии = ФП + назначение инотропных
препаратов в диуретической дозе (допмин или добутамин менее 3 мкг/кг/мин);
3. АД – после кратковременного подъема снижение ниже нормы; ЦВД –
умеренное повышение (значительные потери ОЦК, обусловлены патологической
капиллярной проницаемостью; необходимо продолжать нагрузку объемом; объем
инфузионной терапии превышает ФП + назначение инотропных препаратов в средних
дозах (допмин или добутамин 5,0-10,0 мкг/кг/мин);
4. АД – снижение ниже нормы; ЦВД – повышение выше нормы или его
прирост > 6,5 см вод.ст. (объем инфузионной терапии должен быть уменьшен до
30-70% ФП + назначение нитратов и инотропных препаратов в высоких дозировках +
назначение α-адреномиметиков).
Обратим внимание, что за рубежом назначение нитратов требует
контроля уровня метгемоглобина (MetHb). К сожалению, в России большинство клиник
возможностей определения метгемоглобина не имеют, поэтому назначать данные
препараты врачу приходится на свой страх и риск.
Как хорошо известно, адекватная оценка терапии объемом возможна
только при одновременном измерении АД и ЦВД. При отсутствии измерении указанных
показателей гемодинамики терапия «вслепую» чревата большим количеством
осложнений. Терапия отдельных форм гемодинамических нарушений представлена нами
в конце данной главы.
Физиологическая потребность новорожденного в жидкости
Водный баланс организма поддерживается благодаря адекватному
поступлению воды в соответствии с ее потерями. Как известно, организм получает
воду с пищей и в результате обменных процессов. Потери воды происходят через
легкие (путем перспирации), кожу (потение), с калом и мочой. Суточная
потребность организма в жидкости зависит от ее потерь. В норме эти потери
определяются: температурой и влажностью окружающей среды, температурой тела,
массой и поверхностью тела, возрастом. У взрослого человека эта потребность
колеблется от 1,0 до 3,0 литра и более. Поскольку у новорожденного ребенка общее
количество воды составляет 80% от массы тела, то потребность в жидкости в
зависимости от внешних условий может отличаться в несколько раз. На наш взгляд,
в неонатальной медицине происходит некоторое смещение понятий: в какой-то
степени мы «путаем» физиологическую потребность в жидкости ребенка, пусть даже и
глубоконедоношенного, имеющего физиологическое состояние, и потребность в водной
нагрузке больного новорожденного с определенной нозологией.
Например, если здоровый ребенок нуждается в определенной
температуре окружающей среды (около 25-27 °С), определенном проценте кислорода
во вдыхаемом воздухе (21%), определенном количестве пищи и воды (зависит от
суток жизни), то нельзя механически перенести эти показатели на больного
новорожденного и недоношенного, что по существу и не делается в клинической
практике. И хорошо известно, что в очень широком диапазоне может колебаться
потребность больного в кислороде во вдыхаемой воздушной смеси, потребность в
дополнительном обогреве или охлаждении, по требность в энергетической нагрузке.
Точно так же разной будет потребность в водной нагрузке в зависимости от
патологии, ее тяжести и стадии развития.
По нашему мнению, большой диапазон физиологических потребностей в
жидкости, указываемых разными авторами (Цыбулькин Э.К., 1984, Гомелла Т.Л.,
1998; Avery G. et al., 2000) определяется различием технологий ухода за
новорожденными и недоношенными, а также травматичностью первичного пособия после
рождения (см. таблицы 113-114).
Таблица 113. Суточные физиологические потребности в жидкости у
новорожденных (Цыбулькин Э.К., 1984)
|
День жизни
|
Вес детей
|
|
более 2500 г
|
1500-2500 г
|
менее 1500 г
|
|
потребность в жидкости (мл/кг/сут.)
|
|
1
|
25
|
70
|
90
|
|
2
|
25
|
80
|
100
|
|
3
|
40
|
90
|
100
|
Окончание таблицы 113
|
День жизни
|
Вес детей
|
|
более 2500 г
|
1500-2500 г
|
менее 1500 г
|
|
потребность в жидкости (мл/кг/сут.)
|
|
4
|
60
|
110
|
110
|
|
5
|
90
|
120
|
120
|
|
6
|
115
|
120
|
130
|
|
7
|
130
|
130
|
140
|
|
8
|
140
|
135
|
140
|
|
9
|
150
|
140
|
150
|
|
10
|
150
|
140
|
150
|
Таблица 114. Потребности в жидкости у новорожденных детей (Avery
G., 2000)
|
Вес (г)
|
Возраст (сут.)
|
|
1-2
|
3-7
|
7-30
|
|
мл/кг/сут.
|
|
≤ 750
|
100-250
|
150-300
|
120-180
|
|
750-1000
|
80-150
|
100-150
|
|
1000-1500
|
60-100
|
80-150
|
|
1500-2500
|
60-80
|
|
≥ 2500
|
Считаем необходимым обратить внимание на один аспект данной
проблемы, особенно важный для нашей страны в настоящее время в связи с
изменением официального отношения к выхаживанию глубоконедоношенных детей.
Конечно, глубокая недоношенность, и не только по нашему мнению, а и по мнению
выдающихся педиатров (Маслов М.С., 1928; Тур А.Ф.,
1962), является тяжелым патологическим состоянием, чаще всего даже
не патологическим, а экстремальным, что полностью соответствует международному
названию данной группы: дети с экстремально низкой массой тела. Укажем на
некоторые феномены глубоконедоношенных применительно к данной главе. Знание этих
особенностей позволяет порой помочь больному. Как мы уже указывали, организм
глубоконедоношенного ребенка, а уж тем более новорожденного с экстремально
низкой массой тела при рождении имеет более высокое содержание воды, чем
доношенного.
Установлено (Friis-Hansen B., 1956), что содержание воды у
доношенного ребенка составляет 77%, у новорожденного, родившегося на сроке
гестации 32 недели, – 82%, на сроке гестации 28 недель – 84%, а на сроке 24
недели – 86%. Заметим, что первая работа, посвященная биохимическому составу
организма плода, появилась в 1857 году, а выполнил ее von Bezold A. (цит. по
Hartnoll G. et al., 2000).
Как известно, кожа новорожденного ребенка имеет выраженные
гестационнозависимые особенности. Чем меньше срок гестации, тем тоньше роговой
слой эпидермиса, имеются особенности строения мембранных белков кожи, выше рН и
т.д. (Нобл У.К., 1986). Потери жидкости у глубоконедоношенных в основном
происходят через кожу. Чтобы понять, насколько это значимо, достаточно
посмотреть на рисунок 58.
Есть огромная зависимость между сроком гестации и трансдермальными
потерями воды, особенно в первые сутки. Так, новорожденный ребенок, родившийся
на сроке гестации 25 недель, теряет через кожу в 15 раз больше воды, чем
родившийся доношенным. Затем эти различия значительно стираются (рисунок 59), но
все равно даже в конце неонатального периода у глубоконедоношенных потери через
кожу в 2 раза превосходят потери у доношенных. Необходимо помнить, что потеря
воды приводит к увеличению осмолярности плазмы крови со всеми вытекающими отсюда
последствиями (см. главу 15).
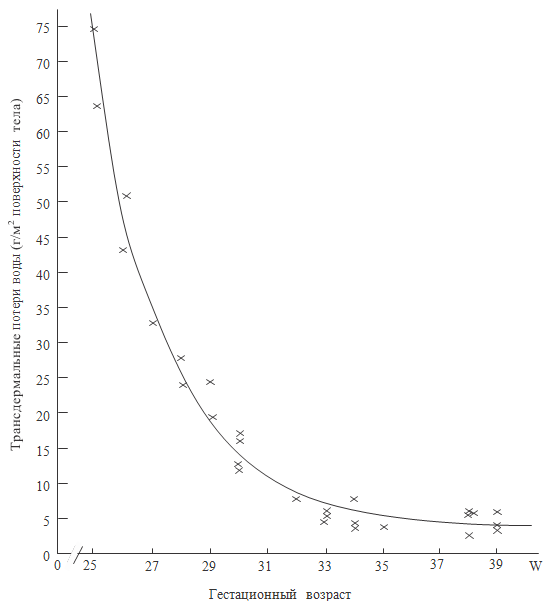
Рисунок 58. Трансдермальные потери воды в зависимости от срока
гестации (Hammarlund K., Sedin G., 1979)
Вышесказанное приводит к необходимости: во-первых, введения б льших
объемов жидкости на кг массы тела у глубоконедоношенных, а во-вторых, к попыткам
уменьшения трансдермальных потерь жидкости, а также потерь через респираторный
тракт. И на первом месте среди методов, позволяющих снизить указанные потери –
создание определенной влажности (см. рисунок 60) и температуры (см. главу 10).
Имеются попытки создания специальных парафиновых барьеров (Rutter
N., 2000) и специальных мазей (Pabst R.C. et al., 1999) для уменьшения
трансдермальных потерь воды глубоконедоношенными детьми.
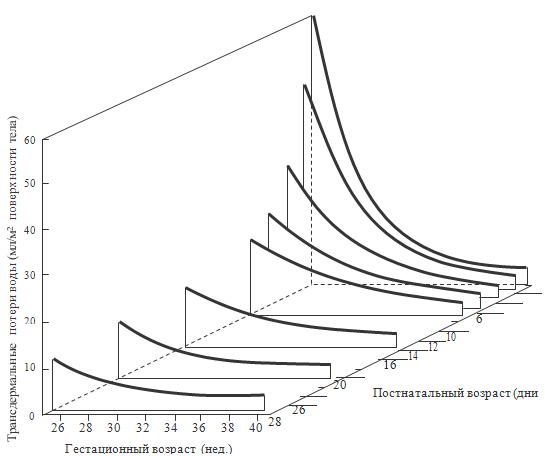
Рисунок 59. Трансдермальные потери воды у детей различного срока
гестации в течение первых 40 дней жизни (Hammarlund K., Sedin G., 1983)
Что касается инфузионной терапии, то в настоящее время в г.
Санкт-Петербурге при ее проведении, по крайней мере в ДГБ № 1, отмечается
тенденция к использованию меньших объемов жидкости, чем это было 10-15 лет
назад, руководствуясь следующими принципами.
Общие принципы инфузионной терапии
Инфузионная терапия – комплекс лечебных мероприятий, направленных
на сохранение гомеостаза (водно-электролитного и кислотно-основного баланса)
организма и коррекцию его нарушений.
В задачи инфузионной терапии входят:
– коррекция водно-электролитных нарушений, развившихся
внутриутробно или вследствие угрожающего состояния постнатально;
– сохранение водно-электролитного баланса посредством компенсации
потерь жидкости и электролитов, обеспечение энергетических нужд и течения
пластических процессов при невозможности энтерального питания (ранний период
после критического состояния, перенесенного в родах и адаптации глубоко
незрелых детей);
– коррекция сердечно-сосудистых нарушений, развившихся
внутриутробно или постнатально.
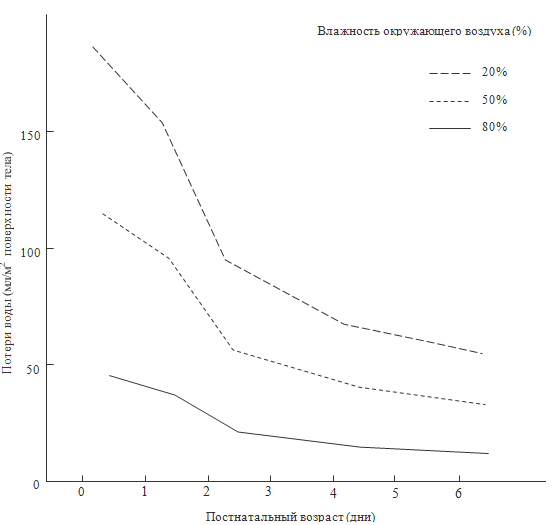
Рисунок 60. Количество трансдермальных потерь в зависимости от
влажности окружающего воздуха у детей со сроком гестации 25-27 недель (Sedin G.
et al., 2006)
Показания для проведения инфузионной терапии у новорожденных:
– состояния, сопровождающиеся нарушениями процессов метаболизма и
нарушения функции жизненно важных органов (тяжелая интранатальная асфиксия,
ГБН, ДВС-синдром, сепсис, ОПН, декомпенсированная СН и др.);
– состояния, сопровождающиеся нарушенной толерантностью к
энтеральной нагрузке (кишечные инфекции, ЯНЭК, хирургическая патология ЖКТ);
– незрелость органов и систем регуляции водно-электролитного
баланса и толерантности к энтеральному питанию у глубоконедоношенных детей.
Естественно, что инфузионную терапию следует рассматривать как этап до
введения парентерального или энтерального питания.
При проведении инфузионной терапии необходимо учитывать следующие
анатомофизиологические особенности новорожденного:
– новорожденные дети, имея низкую способность к концентрации
мочи, очень чувствительны к снижению объема поступающей жидкости;
– характерны для новорожденных большая величина отношения площади
поверхности тела и респираторного тракта к массе тела;
– тонкая и богато васкуляризированная кожа, высокое содержание
воды на единицу массы тела при частом дыхании обуславливают значительный
уровень «неощутимых» потерь жидкости, вызванных испарением ее с поверхности
тела и дыхательных путей (см. рисунки 58, 59);
– почки новорожденного не способны быстро ответить на резкое
увеличение водной нагрузки немедленным выведением избытка внеклеточной
жидкости;
– клиренс свободной воды может быть снижен в связи с повышением
секреции антидиуретического гормона при интранатальной асфиксии, ВЖК, СДР,
проведении ИВЛ, пневмотораксе. Его уровень тем выше, чем тяжелее состояние
ребенка при рождении;
– несмотря на высокий уровень выведения натрия почками,
недоношенные дети имеют низкую способность к выведению избытка натрия при
перегрузке;
– для новорожденных характерен более высокий уровень калия плазмы
крови в первые трое суток жизни, но способность к экскреции данного
электролита тоже низка.
При проведении инфузионной терапии у новорожденных необходимо
руководствоваться
следующими принципами:
– объем жидкости является основным фактором, определяющим
адекватность инфузионной терапии;
– необходимость постепенности (поэтапности) (Цыбулькин Э.К.,
1984) увеличения водной нагрузки и введения в состав инфузионной программы
новых компонентов с учетом индивидуальных особенностей постнатального
созревания функции почек или ее восстановления при патологических состояниях;
– необходимость проведения клинико-лабораторного контроля
водно-электролитного баланса для оценки адекватности инфузионной программы.
Факторы, определяющие потребности в жидкости у новорожденного,
следующие.
«Неощутимые» потери жидкости, обусловленные испарением с
поверхности тела и дыхательных путей (см. рисунок 59). Величина этих потерь
обратно пропорциональна весу при рождении и гестационному возрасту. Как уже
указывалось, примерно 30% «неощутимых» потерь происходит при увлажнении газовой
смеси в дыхательных путях и 70% путем испарения с кожи. Потери жидкости через
дыхательные пути могут существенно увеличиваться, например, если ребенок
находится на ИВЛ, а воздушно-кислородная смесь адекватно не увлажнена. Еще раз
подчеркнем, что у глубоконедоношенных детей максимальные потери происходят
трансдермально (выше мы подробно на этом останавливались) и могут составлять 140
мл/кг/сут. При этом обращаем внимание, что на испарение 1 мл воды с поверхности
кожи расходуется
560 калорий (Modi N., 2004), поэтому вопросы теплового баланса,
особенно у глубоконедоношенных новорожденных имеют очень важное значение в их
выхаживании (см. главу 10). Особое внимание хотим обратить на влажность в
инкубаторе. Показано (Takahashi N. et al., 1994), что если влажность снижается с
60 до 20%, то трансдермальные потери воды увеличиваются на 100%, а если
влажность менее 90%, то неощутимые потери воды у детей с массой тела менее 1000
г при рождении составляют 40 мл/кг/сут. Если ребенок находится под лучистым
источником тепла, то он также должен увлажняться, хотя это и представляет
определенные технические сложности.
Потери жидкости со стулом составляют 5-10 мл/кг/сут. В первые дни
жизни они обычно не учитываются, так как потери жидкости с меконием
незначительны.
Задержка жидкости в новых тканях в течение роста. Для недоношенных
обычно прибавка массы тела составляет 1-2% в сутки и 60-70% ее составляет вода.
Учитывается начиная со второй недели жизни.
Безопасный для новорожденного ребенка объем диуреза определяется
пределами концентрационной способности почек. Осмолярность мочи около 300
мосмоль/л близка к среднему уровню, который могут продуцировать почки новорожденного, и
является показателем безопасной водной нагрузки. Таким образом, как указывает
Зильбер А.П. (1984), осмолярность, в том числе и мочи, является лабораторным
показателем, требующим контроля в практике интенсивной терапии.
Патологические потери жидкости и электролитов: с желудочным
содержимым при срыгивании, ликворея, кровотечения, «хирургические потери» из
ран, дренажей и т.д.
Как видно из таблицы 114 у новорожденных детей отмечают три
периода, в каждом из которых объем вводимой жидкости различен.
Первый период (1-2 сутки жизни) может быть назван переходным.
Он характеризуется большими потерями жидкости за счет значительных потерь
испарением и выведением значительного объема внеклеточной жидкости и
электролитов почками. В этот период расчет объема инфузионной терапии будет
определяться следующими обстоятельствами. В первые двое суток жизни почки
доношенного новорожденного, получающего внутривенно жидкость и электролиты
должны экскретировать около 15 мосм/кг/сутки (Папаян А.В., Стяжкина И.С., 2002).
Объем диуреза 50 мл/кг/сутки и неощутимые потери воды 20 мл/кг/сутки
обуславливают потребность в жидкости = 70 мл/кг/сутки. При этом расчете
пренебрегают потерей жидкости со стулом и задержкой воды в тканях. С учетом
отрицательного водного баланса 5-10 мл/кг/сутки истинная потребность в воде
составляет 60-65 мл/кг/сутки.
Естественно, что у недоношенных детей, имеющих большие «неощутимые»
потери воды, потребность в жидкости больше. В течение первых дней жизни у
недоношенных детей экскреторная нагрузка почек мала и составляет 8 мосм/кг/сутки
электролитов, образующихся при тканевом катаболизме и 2 мэкв/кг/сутки хлорида
натрия (4 мосм/кг/сутки), вводимых с инфузионной терапией со 2-3 суток жизни.
Для экскреции этой нагрузки почками при осмолярности мочи = 300 мосм/л
достаточен диурез 40-50 мл/кг/сутки. Таким образом, недоношенные дети с массой
тела менее 1500 г требуют 80-100 мл/кг/сутки (60-70 мл – неощутимые потери
жидкости + 40-50 мл – диурез – 10-15 мл для негативного баланса) в первые-вторые
сутки жизни.
Как уже отмечалось, у глубоконедоношенных и детей с экстремально
низкой массой тела при рождении неощутимые потери жидкости еще выше. Их
потребности в жидкости могут составлять 150-250 мл/кг/сутки.
NB. У новорожденных, особенно недоношенных, должен осуществляться
тщательный контроль водно-электролитного баланса, поскольку последствия
жидкостной перегрузки могут быть выражены и трудно исправимы.
С увеличением постнатального возраста и началом энтерального
питания повышается экскреция электролитов почками и потери воды со стулом,
начинается задержка воды в новых тканях. Поэтому с 3-4 суток жизни потребность в
жидкости увеличивается.
Второй период (стабилизации) характеризуется стабилизацией
массы тела. Уменьшаются потери жидкости испарением за счет кератинизации кожных
покровов. В этот период обычно происходит осторожное введение и/или расширение
энтеральной нагрузки и компонентов парентерального питания. Начинается
положительная динамика веса.
Третий период (стабильного роста) начинается со 2-3 недели
жизни. В этот период потребности в жидкости и электролитах для детей различного
гестационного возраста одинакова.
В заключение считаем необходимым остановиться на вопросах, которые
можно охарактеризовать как «предвидеть и предотвращать», основанных на
исследовании Modi N. (2003) (см. таблицу 115).
Таблица 115. Предотвращение побочных эффектов инфузионной терапии (Modi
N., 2003)
|
Трансдермальная потеря воды может быть большой, особенно у
недоношенных |
Совершать активные действия для предотвращения трансдермальной
потери жидкости |
|
Потребность в глюкозе может быть различной |
Использовать объемонезависимые источники глюкозы |
Окончание таблицы 115
|
Нет необходимости в парентеральном введении натрия, пока
постнатальные изотонические потери экстрацеллюлярной жидкости незначительны |
Не назначать натриевые растворы до того, как потеря массы тела
не будет около 6% |
|
Жидкостная терапия является предметом клинического обсуждения и
зависит
от клинической ситуации |
Наблюдать тщательно и длительно |
|
Питательная и гидратирующая цели инфузионной терапии очень
связаны, но все же не идентичны |
Следует четко различать эти цели |
|
Не вводите фуросемид при каждом переливании эритроцитарной
массы |
Трансфузия эритроцитарной массы в дозе 3 мл/кг/ч не приводит к
перегрузке объемом у детей с ЭНМТ |
|
Не вводите фуросемид повторно детям
с олигурией. Детям без олигурии повторное введение может быть
произведено только через
24 часа после первого введения |
Клиренс фуросемида низкий и период полувыведения его у детей с
постконцептуальным возрастом менее 31 недель составляет 24 часа. Повторное
введение может привести
к аккумуляции и усилению ототоксичности, увеличению риска
интерстициального нефрита и ОАП |
|
Не ограничивайте объем жидкости во всех случаях, когда имеются
признаки ОАП |
Ограничивайте только в случаях доказанной перегрузки объемом;
рутинное ограничение жидкости может негативно влиять на питание |
|
Всякий раз, изменяя введение жидкости, думайте о том, что
является основной целью вашей ИТ – питание или гидратация |
Если гидратация достаточная, то нет необходимости
в постепенном увеличении объема вводимой жидкости после
рождения, кроме случаев, когда необходимо восполнять дефицит питательных
веществ |
|
Ежедневные изменения массы тела |
Отсутствие убыли массы тела после рождения или прирост
ее свидетельствуют об избытке жидкости в организме; обычно
причиной этого является неполноценная экскреция натрия и/или вода |
|
Концентрация натрия |
Гипонатриемия предполагает избыток жидкости, а гипернатриемия –
ее дефицит |
|
Объем мочи |
1 мл/кг/час требует обследования; 2-4 мл/кг/час – нормальная
гидратация; > 6-7 мл/кг/час – нарушение концентрационной функции почек или
избыточное введение жидкости |
Немаловажный вопрос, какой раствор вводить при коррекции гипотензии
– кристаллоиды или коллоиды, особенно у глубоконедоношенных новорожденных. Как
известно, эти растворы имеют два принципиальных различия: во-первых, коллоиды,
согласно закону Старлинга, создают онкотическое давление, с другой стороны,
теоретически – должны более долго находиться в сосудистом русле. Работы
последних 10-15 лет установили (Emery E.F. et al., 1992; King W.S.O. et al.,
1997), что количество раствора более важно, чем содержания белка в нем,
изотонический раствор хлорида натрия также эффективен как 5% альбумин. При
введении кристаллоидов гораздо реже развиваются отеки, они в 50 раз дешевле и не
несут угрозу заражения. Длительные катамнестические исследования (Northern
Neonatal Nursing Initiative Trial Group, 1996) не демонстрируют преимуществ
инфузии коллоидов (плазмы, альбумина) по сравнению с кристаллоидами на
показатели летальности, инвалидизации, нарушений нервнопсихического развития и
т.д. Конечно, все это не касается введения растворов аминокислот (van den Akker
С. et al., 2007), но этот вопрос связан с проблемами парентерального питания и в
данной монографии мы его подробно рассматривать не будем. Врач должен помнить,
что инфузионная терапия достаточно агрессивна по отношению к организму больного
(см. таблицу 116) и должна проводится только по показаниям.
Таблица 116. Побочные эффекты коллоидов и кристаллоидов (сводные
литературные данные)
|
Побочные эффекты и опасности
|
|
Коллоиды
|
Кристаллоиды
|
|
Желатиноль – аллергические реакции, короткое действие.
Гелофузин лишен этих недостатков.
|
Гиперволемия – перегрузка миокарда, гипергидратация малого
круга кровообращения |
Окончание таблицы 116
|
Декстраны – аллергические реакции, влияние на гемостаз |
Легкость развития тканевых отеков |
|
Альбумин– высокая стоимость, низкая эффективность |
Угнетение иммунитета |
|
Гиперхлоремический ацидоз – NaCl |
|
Гиперосмолярность – раствор Рингера-лактата |
|
Нарушения микроциркуляции – гиперкоагуляция, энтеропатия и др. |
Обращаем внимание, что при проведении инфузионной терапии должен
осуществляться клинико-лабораторный контроль за:
1) весом тела (1-2 раза в сутки);
2) количеством поступивших всеми путями жидкости и электролитов;
3) потерями жидкости и электролитов с диурезом и стулом;
4) уровнем электролитов плазмы крови (1-2 раза в сутки);
5) уровнем креатинина и мочевины плазмы крови;
6) неощутимыми потерями воды;
7) патологическими потерями воды и электролитов (желудочный
застой, срыгивания, диарея; дренажи и т.д.);
8) функцией почек (удельный вес и осмолярность мочи). В таблице
117 представлены данные по лабораторному контролю за детьми с различными
сроками гестации, принятому в США.
Таблица 117. Минимально необходимый лабораторный контроль у
новорожденных различного гестационного возраста, принятый в США (Lorenz J.M.,
1997)
|
Гестационный возраст
|
Показатель
|
График мониторирования
|
|
≤ 25 недель |
Na, K, C1, tCO 2
2 |
в 8-12 часов, затем каждые 8-12 часов до стабилизации или
появлению тенденции к нормализации, затем ежедневно |
|
глюкоза |
обычно часто определяется с помощью тест-полосок. При низких
показателях определяют глюкозу плазмы для достоверного подтверждения
гипогликемии |
|
Ca |
в 12-24 часа, затем каждые 8-12 часов до тех пор, пока
показатели
не начнут снижаться; потом каждые 24 часа, пока не достигнет
нормы без дополнительного введения кальция |
|
креатинин |
в 8-12 часов, затем ежедневно |
|
26-30 недель |
Na, K, C1, tCO 2
2 |
в 12-24 часа жизни; затем каждые 8-12 часов до стабилизации или
появлению тенденции к нормализации, потом ежедневно |
|
глюкоза |
см. выше |
|
Ca |
в 12-24 часа жизни, затем каждые 8-12 часов до тех пор, пока
показатели не начнут снижаться; потом каждые 24 часа, пока не достигнет
нормы без дополнительного введения кальция |
|
креатинин |
в 12-24 часа, затем ежедневно |
|
30-34 недель |
Nа, K, C1, tCO 2
2 |
в 18-24 часов, затем ежедневно |
|
глюкоза |
см. выше |
|
Ca |
в 18-24 часов, затем ежедневно, пока не достигнет нормы без
дополнительного введения кальция |
|
креатинин |
в 18-24 часов, затем только в случае подозрения на возможность
развития нарушения функций почек |
|
≥ 34 недель, получающие инфузионную терапию |
Na, K, C1, tCO 2
2 |
в 18-24 часов, затем ежедневно |
|
глюкоза |
см. выше |
|
Ca |
см. выше, но только при наличии факторов риска гипокальцемии
(кроме недоношенности) или клинических проявлений гипокальцемии |
|
креатинин |
в 18-24 часов, затем только в случае подозрения на возможность
развития нарушения функций почек |
Окончание таблицы 117
|
Гестационный возраст
|
Показатель
|
График мониторирования
|
|
≥ 34 недель,
не получающие инфузионную терапию |
Na, K, C1, tCO 2
2 |
только при патологической убыли массы тела или патологической
потере воды и электролитов |
|
глюкоза |
см. выше, но только при наличии факторов риска гипогликемии или
клинических проявлений гипогликемии |
|
Ca |
см. выше |
|
креатинин |
только в случае подозрения на возможность развития нарушения
функций почек |
Примечания. 1. Гестационный возраст приведен приблизительно,
он не является обязательным четким порогом.
2. Если кислотно-основное состояние оценивается
одновременно с газами крови, регулярная оценка C1 и tCO
(общий углекислый газ), вероятно, не нужна, если вычисление
анионного интервала не представляет интерес.
К сожалению, существует мало доступной информации
относительно полноценного анионного интервала у новорожденных. Кроме того,
если образец получен из кожи без нагревания, то tCO может быть заниженным.
Обсуждая лабораторный контроль, зарубежные коллеги обращают
внимание на несколько аспектов. Во-первых, врачи-клиницисты обязаны знать
нормальные величины лабораторных показателей у новорожденных в зависимости от
дня жизни (см. приложение 15). Во-вторых, врачи-клиницисты обязаны знать предел
и диапазон допустимых ошибок, принятых в лабораториях тех стационаров, где они
работают. В таблице 118 представлен предел ошибок, принятый в США согласно
протоколу лабораторных поправок с 1988 года (Clinical Laboratory Improvement
Amendments of 1988). В-третьих, врачи-клиницисты обязаны знать, какое количество
крови необходимо для того или иного метода исследования, потому что
флеботомические потери у новорожденных, особенно у глубоконедоношенных, могут
быть значительны и требовать терапии, в том числе и переливания компонентов
крови. Например, потеря 8,0 мл крови у ребенка с массой тела 750 г может уже
потребовать переливания эритроцитной массы (Lenes B.A., Scher R.A., 1983). Такие
же данные получил, выполнивший диссертационное исследование Жетишев Р.А. в 2004
году. Конечно, это диктует необходимость применения микрометодов в лабораторной
практике интенсивной неонатологии. С огромной грустью приходится констатировать
тот факт, что в большинстве родовспомогательных стационаров нашей страны нет ни
только микрометодов, но и вообще возможности, особенно в ночное время и в
праздничные дни, определить порой основные биохимические показатели. Зная и
учитывая это, мы все-таки считаем необходимым указать, «как должно быть». Кроме
знаний, необходимых врачу, все-таки имеется надежда, что когда-то, и может, в
недалеком будущем что-то изменится.
Таблица 118.
Предел
допустимых лабораторных
ошибок (Clinical Laboratory Improvement Amendments of 1988)
|
Натрий |
±4 ммоль/л
|
|
Калий |
±0,5 ммоль/л
|
|
Хлор |
±5%
|
|
Глюкоза |
±10%
|
|
Общий кальций |
±0,25 ммоль/л
|
|
Креатинин |
±26 ммоль/л или 15% (выбирается больший)
|
Интропная поддержка
Единого мнения в литературе по поводу выбора стартового инотропного
препарата нет. В России, как правило, стартовым препаратом инотропной поддержки
выбирается допамин в дозе 2,5-5,0 мкг/кг/мин Основные дозозависимые эффекты
инотропных препаратов представлены в таблице 119.
За рубежом имеются рекомендации (Roze et al., 1993) проведения
стартовой инотропной терапии добутамином в дозе от 10 до 20 мкг/кг/мин, учитывая
редуцирующие влияние допамина на ренальный кровоток в дозе более 4 мкг/кг/мин, а
также доказанное влияние допамин на сопротивление сосудов (повышение) и
сердечный выброс (уменьшение).
Osborn D.A. et al. (2000) показали, что в
дозе 10 мкг/кг/мин добутамин и допамин оказывают одинаковое влияние как на
давление, так и на кровоток, а в больших дозах допамин повышает давление, но
редуцирует кровоток, а добутрекс, не влияя на давление, увеличивает кровоток. В
их наблюдении исследовался также мозговой кровоток. Оказалось, что у 40%
глубоконедоношенных детей, несмотря на нормальные показатели давления и
кровотока, поддерживаемые допамином или добутрексом, мозговой кровоток продолжал
оставаться низким. Хотя в недавнем двойном «слепом» исследовании Pellicer A. et
al. (2005) показали высокую корреляцию между уровнем среднего артериального
давления у глубоконедоношенных детей, поддерживаемого адреналином (0,5
мкг/кг/мин) или допамином (10 мкг/кг/мин), и показателями мозгового кровотока. В
связи с этим некоторые исследователи (Kluckow M., Evans N.J.,
2003; Munro M.J. et al., 2004; Evans N., 2006) подчеркивают, что
если перед врачом прежде всего стоит задача стабилизации артериального давления,
то лучше начинать терапию с введения адреналина. При этом необходимо учитывать
исходное артериальное давление, вернее, величину артериальной гипотензии, потому
что установлено, что резкий подъем АД приводит к развитию реперфузионных
повреждений и прежде всего внутричерепных кровоизлияний. Адреналин должен быть
назначен в низкой дозе (0,025-0,1 мкг/кг/мин), тщательно титроваться и АД на
максимальной дозе не должно превышать 5 мм рт.ст. от возрастной нормы.
Таблица 119. Характеристика основных адренергических препаратов (Меньшугин
И.Н., 1998)
|
Препарат
|
Доза
|
Периферический сосудистый эффект
|
Миокардиальный эффект
|
Комментарий
|
|
|
α
|
β2
|
δ
|
β1
|
β2
|
|
|
Дофамин |
1-3 мкг/кг/мин |
0
|
0
|
2+
|
0
|
0
|
спланхнитический и почечный вазодилятатор |
|
Дофамин |
4-7 мкг/кг/мин |
0
|
2+
|
2+
|
1-2+
|
1+
|
подобен изопретеренолу |
|
Дофамин |
> 10 мкг/кг/мин |
2-4+ |
0
|
0
|
1-2+
|
2+
|
с увеличением дозы возрастает прессорный эффект |
|
Добутамин |
2-10 мкг/кг/мин |
1+
|
2+
|
0
|
3-4+
|
1-2+
|
эффект подобен дофамину; в малых дозах имеет меньший
хронотропный
и аритмогенный эффект |
|
Адреналин |
0,05-0,2 мкг/кг/мин |
2+
|
1-2+ |
0
|
2-3+
|
2+
|
превалирует β2 эффект; препарат выбора при анафилаксии |
|
Адреналин |
0,2-1,0 мкг/кг/мин |
4+
|
0
|
0
|
4+
|
3+
|
тот же |
В нашей стране при отсутствии эффекта от допамина в дозе 5,0-7,5
мкг/кг/мин в условиях адекватной нагрузки объемом и рН не менее 7,25, принято
увеличение вводимой дозы более 7,5-10 мкг/кг/мин. Однако повышение указанной дозы ведет к снижению
β1-эффекта допамина. По этой причине для сохранения и усиления β1-эффекта
назначается добутамин в дозе 5-20 мкг/кг/мин.
При недостаточном эффекте или отсутствия эффекта от добутамина
третьим препаратом назначается адреналин, лучше сохраняющий свои инотропные
свойства при низком рН (см. рисунок 61). Дозы адреналина колеблются от 0,025 до
1,0 мкг/кг/мин.
Конечно, при выборе инотропного препарата необходимо учитывать
патологию, которую переносит больной. Например, Зедгенизова Е.В (2007) показала,
что инфузия дофамина в дозе 3-5 мкг/кг/мин обладает выраженным инотропным эффектом у детей,
перенесших острую тяжелую асфиксию, а у детей, перенесших сочетанную гипоксию
для достижения достаточной насосной функции и сократительной способности сердца
необходима доза дофамина 7-10 мкг/кг/мин. Ниже мы более подробно остановимся на тактике при
различных формах неонатальной патологии.
При лечении гемодинамических нарушений необходимо учитывать, что
некоторые дети, особенно недоношенные, имеют транзиторную надпочечниковую
недостаточность, что позволяет в качестве этапного лечения применять
глюкокортикостероиды. Преимущественно в зарубежной литературе (Ng P.C. et al.,
2004; Fernandez E. et al., 2005; Noori S. et al., 2005) обращают внимание на то,
что глюкокортикоиды при наличии гемодинамических расстройств применяются все
чаще и чаще с достаточно хорошим эффектом, особенно у детей с рефрактерностью к
инотропам. Исключением из этой ситуации является гипотензии в структуре
септического шока. По крайней мере вопрос о применении стероидов при сепсисе без
доказанной надпочечниковой недостаточности является дискутабельным. Указывают (Landry
D.W., Oliver J.A., 2001), что препаратами выбора для лечения гипотензии при
сепсисе являются вазопрессин и ингибиторы синтетазы оксида азота.
Что касается стероидов, то препаратом выбора при этом является
гидрокортизон (1,0-3,0 мг/кг/сутки) в течение 1-3 суток. Целесообразно
внутривенное микроструйное введение препарата с равномерным распределением дозы
в течение суток. Так, Bourchier D. et al.
Рисунок 61. Зависимость эффекта инотропных препаратов от рH в
артериальной крови
Рисунок 62. Влияние гидрокортизона и плацебо на среднее
артериальное давление у глубоконедоношенных новорожденных (Ng P.C. et al., 2006)
в 1997 показали, что введение гидрокортизона в дозе 2,5 мг/кг через
каждые 4 часа позволило увеличить АД у 81% детей. К сожалению, указанные авторы
подчеркивают, что отдаленные последствия такой терапии неизвестны.
Ng P.C. et al. (2006) в рандомизированном «двойном слепом»
исследовании показали (см. рисунок 62 и таблицу 120), что введение
гидрокортизона в дозе 3 мг/кг/сутки, разделенных на 3 приема в сутки (т.е. 1 мк/кг
каждые 8 часов), в течение 5 суток позволяет стабилизировать артериальное
давление при рефрактерной к инотропам гипотензии.
Кроме устранения гипотензии, введение гидрокортизона позволило у
79% детей в течение 72 часов «уйти» от инотропной поддержки, снизить дозу
инотропных препаратов и объем инфузии. С другой стороны (см. таблицу 120),
введение гидрокортизона не позволяет сократить длительность кислородотерапии и
ИВЛ, частоту хронических неспецифических заболеваний легких (БЛД),
продолжительности госпитализации, летальности, но в то же время не влияет на
частоту возникновения гипергликемии, язвенно-некротического колита, перфорации
кишечника, бактеремии и сепсиса. Аналогичные результаты получили Noori S. et al.
в 2006 году, используя гидрокортизон, но в меньшей дозе (2 мг/кг/сутки) у
доношенных и недоношенных детей. Они также подчеркивают, что в отличие от
высоких доз допамина, гидрокортизон, по данным доплерографического исследования,
не снижает почечный и мозговой кровоток.
Таблица 120. Клинико-лабораторные показатели у детей, получавших и
не получавших гидрокортизон (Ng P.C. et al. 2006)
|
Признаки
|
Группа, получавшая гидрокортизон
(n = 24)
|
Группа, получавшая плацебо (n = 24)
|
р
|
|
Сердечно-сосудистая система
|
|
Максимальная доза допамина (мкг/кг/мин) |
16 (10-20)
|
20 (14-30)
|
0,088
|
|
Накопленная доза допамина (после рандомизации) (мкг/кг) |
14 310 (6510-23 768) |
51 875 (24 385-96 413) |
<0,001a |
|
Максимальная доза добутамина (мкг/кг/мин) |
0 (0-0)
|
0 (0-24)
|
0,009a
|
|
Накопленная доза добутамина (после рандомизации) (мкг/кг) |
0 (0-0)
|
0 (0-70 313)
|
0,002a
|
|
Максимальная доза эпинефрина (мкг/кг/мин) |
0 (0-0)
|
0 (0-0)
|
0,25
|
|
Накопленная доза эпинефрина (после рандомизации) (мкг/кг) |
0 (0-0)
|
0 (0-0)
|
0,23
|
|
Детей, получавших более 1 инотропа |
2 (8)
|
11 (46)
|
0,009a
|
|
Длительность инотропной поддержки (ч) |
39 (28-64)
|
81 (47-136)
|
0,001a
|
|
Использование дополнительного объема (после рандомизации)
(мл/кг) |
30 (0-43)
|
71 (30-161)
|
0,022a
|
|
Дыхательная система
|
|
Длительность IPPV/HFOV (дн.) |
10 (3-44)
|
15 (3-30)
|
0,92
|
|
Длительность вентиляции с ПДКВ, включая назальный CPAP (дн.) |
37 (8-78)
|
43 (9-58)
|
0,63
|
|
Длительность кислородозависимости (дн.) |
19 (2-58)
|
20 (3-40)
|
0,72
|
|
Максимальное FIO2
|
0,5 (0,4-1,0)
|
0,5 (0,4-0,8)
|
0,77
|
|
Максимальное среднее давление в дыхательных путях (см вод.ст.)
|
11,1 (8,7-13,4)
|
11,2 (8,6-13,8)
|
0,75
|
|
O -зависимость в 36 недель постконцептуального возраста
|
9 (38)
|
8 (33)
|
0,76
|
|
Постнатальное использование дексаметазона |
6 (25)
|
7 (29)
|
0,75
|
|
Легочная интерстициальная эмфизема |
3 (12,5)
|
3 (12,5)
|
1,00
|
|
Легочное кровотечение |
1 (4)
|
2 (8)
|
1,00
|
|
Пневмоторакс |
2 (8)
|
1 (4)
|
1,00
|
|
Другие клинико-лабораторные признаки
|
|
Максимальный уровень глюкозы в плазме (ммоль/л) |
10,7 (7,8-16,5)
|
11,0 (8,0-12,7)
|
0,60
|
|
Глюкозурия |
11 (46)
|
4 (17)
|
0,029a
|
|
ВЖК 3 степени и выше |
3 (13)
|
5 (21)
|
0,70
|
|
ПВЛ |
1 (4)
|
1 (4)
|
1,0
|
|
НЭК |
2 (8)
|
3 (12,5)
|
1,0
|
|
Содержимое желудка
|
|
Зелень (застой желчи) |
8 (34)
|
9 (38)
|
0,81
|
|
Коричневое (кофейная гуща) |
2 (8)
|
3 (12)
|
|
|
Нормальное |
14 (58)
|
12 (50)
|
|
|
Гастроинтестинальная перфорация |
1 (4)
|
2 (8)
|
1,00
|
|
Возраст перехода на полное энтеральное питание (дн.) |
36 (19-50)
|
28 (18-49)
|
0,82
|
|
Сепсис (подтвержденный посевами) |
1 (0-1)
|
0 (0-2)
|
0,94
|
|
Ретинопатия недоношенных 3 степени и выше |
1 (4)
|
2 (8)
|
1,00
|
|
Длительность госпитализации (дн.) |
105 (51-140)
|
111 (53-142)
|
0,92
|
|
Умерло |
4 (17)
|
3 (12,5)
|
1,0
|
Однако, как указывают авторы упомянутых исследований, поводом для
беспокойства и ограничением для рекомендаций широкого применения гидрокортизона
является доказанный повреждающий эффект глюкокортикоидов, по крайней мере
дексаметазона, на нейроны головного мозга.
Как нам известно из литературы, первое постнатальное применение
стероидов у недоношенных детей с СДР, рожденных от матерей, больных сахарным
диабетом, произошло в 1956 году. Их применили Haddad H.M. et al. из Бостона.
Первое сравнительное исследование по применению гидрокортизона у недоношенных
детей было проведено в 1972 году Baden M. et al. Никаких преимуществ
гидрокортизона по сравнению с плацебо авторы не обнаружили.
В 80-х – начале 90-х гг. было проведено большое количество
исследований, показавших, что постнатальное применение стероидов (дексаметазона)
позволяет быстрее снижает фракционное содержание кислорода в
воздушно-кислородной смеси при проведении ИВЛ, а также сократить время
пребывания ребенка на ИВЛ и частоту реинтубаций. Вследствие этого данная терапия
получила широкое распространение во всем мире. К середине 90-х гг. прошлого века
была разработана следующая стратегия применение гормонов (основные работы по
этой стратегии и анализ их экспертами ААП представлен в приложении ):
1) раннее назначение, в первые 96 часов жизни, с быстрым уходом
от терапии;
2) в 7-14 сутки, с быстрым снижением дозы препарата;
3) позднее назначение, у ребенка старше 21 дня (обычно у тех,
кто находится на вспомогательной вентиляции).
Заметим, что по данным Halliday H.L. еt al. (2003) (см.
приложение), относительно эффективной является только третья стратегия,
позволившая снизить количество детей, нуждающихся во вспомогательной вентиляции.
Первая и вторая стратегия никак не повлияли ни на летальность, ни на изменения
параметров проводимой вентиляции.
Позднее было показано (Papile L.A. et al., 1998; Stark A.R. et al.,
1999; Soll R.F. et al., 1999), что назначение дексаметазона увеличивает частоту
желудочных кровотечений, перфораций кишечника, требующих оперативного
вмешательства, сепсиса, менингита, гипергликемий, гипертриглицеридемий, вызывает
повышение уровня свободных жирных кислот, усиление катаболизма белков,
подавление гипофизарно-надпочечниковой системы.
Дальше – больше: был установлен повреждающий эффект дексазона на
нейроны, приводящий к отдаленным тяжелым психоневрологическим нарушениям.
После первой публикации Yeh T.S. et al. (1998) из Тайваня,
доказавших повреждающий эффект дексазона, в начале нынешнего века был выполнен
ряд больших исследований, касающихся этого вопроса (Halliday H.L., Ehrenkranz
R.A., 2000; Barrington K.J., 2001).
К сожалению, даже в работах последних лет четкий механизм
повреждающего эффекта дексазона до конца не расшифрован. Хотя в
экспериментальных работах (Howard H., 1968; Cotterrell M. et al., 1972; Weichsel
M.E., 1974) 60-70-х гг. прошлого века и в недавних исследованиях (Murphy B.P. et
al., 2001) было установлено, что дексаметазон нарушает синтез ДНК, РНК и белка в
нейронах, распределение нейронов в головном мозге, дифференцировку нейронов и
миелинизацию, вызывает стимуляцию апоптоза нейронов, что приводит к необратимым
изменениям в количестве нейронов, весу и размера головного мозга. В соматических
клетках – изменению их размеров и нарушению синтеза ДНК. Несмотря на неясность
патогенеза, в большом количестве клинических исследований (Yeh T.F. et al.,
2004; Doyle L.W. et al., 2005; Washburn L.K. et al., 2006; O'Shea
T.M. et al., 2007) показано, что применение его в ранний неонатальный период
приводит у детей в школьном возрасте по сравнению с детьми, не получавшими
дексазон (группы контроля), к задержке роста, более низким показателям
окружности головы. По сравнению с группами контроля у них отмечается
значительное нарушение моторных навыков и моторной координации, гораздо
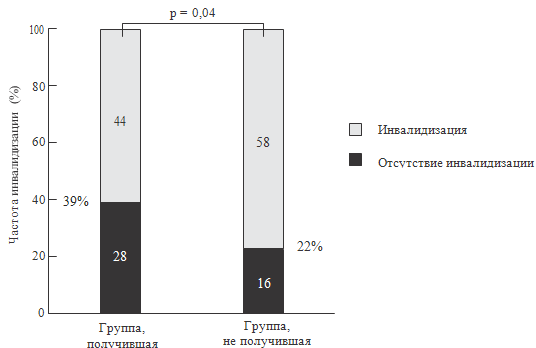
Рисунок 63. Частота инвалидизации у детей школьного возраста,
получавших и не получавших дексаметазон в ранний неонатальный период (Yeh T.F.
et al., 2004)
более низкие показатели интеллекта и развития речи, а инвалидизация
встречается в 2 раза чаще (см. рисунок 63).
Работы конца прошлого – начала нынешнего века привели к тому, что
Комитет по плоду и новорожденному Американской академии педиатрии (American
Academy of Pediatrics, Committee on Fetus and Newborn., 2002) на анализе
проведенных работ в 2002 году сформулировал заключение и дал рекомендации.
Заключения:
1) системное введение дексазона недоношенных детям, находящимся
на механической вентиляции легких, снижает частоту развития хронических
заболеваний легких и неудачных экстубаций, но не влияет на общую летальность;
2) лечение детей, родившихся с экстремально низкой массой тела,
дексаметазоном ассоциируется с повышенным риском непосредственных и отдаленных
осложнений, включая задержку роста и неврологические нарушения;
3) не продемонстрировано непосредственных или отдаленных эффектов
ингаляционных кортикостероидов по профилактике и лечению хронических
заболеваний легких у новорожденных. Рекомендации:
1) основываясь на наличии непосредственных и отдаленных
осложнений, рутинное применение дексаметазона для профилактики и лечения
хронических заболеваний легких у новорожденных с очень низкой массой тела при
рождении не рекомендуется;
2) постнатальное системное применение дексаметазона для
профилактики и/или лечения БЛД должно быть ограничено рандомизированными
двойными слепыми контролируемыми исследованиями. Первичными результатами этих
исследований должно быть выживание детей без отдаленных последствий;
3) изучение отдаленных неврологических результатов у детей,
включенных в подобные исследования, должно настоятельно поощряться;
4) прежде чем могут быть сделаны клинические рекомендации по
применению альтернативных антивоспалительных кортикостероидов, как системных, так
и ингаляционных, должны быть проведены клинические исследования;
5) вне рандомизированных контролируемых исследований применение
кортикостероидов должно быть ограничено исключительно клиническими
потребностями (например, у детей, требующих максимальной дыхательной и
кислородной поддержки). В этих случаях родители должны быть полностью
информированы о возможных непосредственных и отдаленных последствиях такой
терапии и дать согласие на лечение.
Описание отдаленных последствий и рекомендации, данные ААП, привели
к тому, что если в 1993-1995 гг. дексаметазон с целью профилактики и/или лечения
БЛД получали 84% глубоконедоношенных детей в США (Hack M., Fanaroff A.A., 1999),
то в 2003 году 19,3% всех глубоконедоношенных получали гормоны, по данным
анализа, проведенного Finer N.N. et al. (2006) (заметим, что кроме единичных
работ, данных по России найти невозможно). Из этих 19,3% детей, только 3,6%
новорожденных получили гормоны для профилактики или лечения хронических
заболеваний легких, 11,8% – для лечения не связанных с БЛД состояний, например,
для купирования гипотензии или неудачной экстубации, а 4,0% – как для лечения
и/или профилактики БЛД, так и лечения состояний, не связанных с БЛД. Наиболее
частые причины назначения гормонов – купирование гипотензии (гидрокортизоном)
или профилактика реинтубаций (чаще всего дексаметазоном). При этом авторы
отмечают, что дети, имевшие гипотензию и получавшие гидрокортизон, имели
значительно более высокую частоту ВЖК, ПВЛ, летальность по сравнению с детьми,
получавшими гормоны для лечения/профилактики БЛД или не получавшими их вовсе.
Рисунок 64. Динамика применения стероидов и количества
кислородзависимых детей в Израиле (Shinwell E.S. et al., 2007)
Несмотря на эти данные, сообщают (Walsh M.C. et al., 2005), что в
США 7% детей, родившихся с экстремально низкой массой тела, получают
дексаметазон для профилактики и/или лечения БЛД.
Очень хорошо указанные факты подтверждает работа Shinwell E.S. et
al. (2007) из Израиля (см. рисунок 64).
Они обнаружили, что, аналогично США, в Израиле на протяжении
последнего десятилетия в целом происходит резкое снижение использования
стероидов у глубоконедоношенных детей. С другой стороны, намечается и тревожная
тенденция: увеличение количества детей, нуждающихся в длительной
кислородотерапии. И это также мировая тенденция. Она приводит к тому, что в мире
в связи с неясностью вопроса и отсутствием удовлетворяющих большинство
неонатологов рекомендаций продолжаются исследования, целью которых является
попытка ответа на вопросы: какой стероид, какие дозы, как рано и как долго?
В некоторых работах (Jones R.A.K., 2005; Gross S. J. et al., 2005)
подчеркивают, что позднее применение дексазона не влияет, а может быть, даже
улучшает отдаленный неврологический прогноз (Jones R.A.K., 2005; Gross S.J. et
al., 2005). Имеются сообщения (Doyle L.W. et al.,
2006), что даже в более поздние возрастные периоды дексазон должен
применяться в гораздо более низких дозах (0,89 мг/кг в течение 10 суток), чем
это было принято раньше (если в этом есть необходимость согласно рекомендациям
ААП, приведенными нами выше). При этом отмечают, что такие дозы высокоэффективны
для снижения времени интубации у кислородозависимых детей при БЛД.
Как бы там ни было, в последние годы (Rademaker H. et al., 2008)
как альтернативу дексазону для профилактики БЛД начинают предлагать
гидрокортизон. Указывают, что неврологических последствий он не вызывает, но, к
сожалению, долговременных катамнестических исследований по этому поводу мы пока
не нашли. Катамнестические исследования, проведенные через 2 года у детей,
получавших гидрокортизон в ранний неонатальный период для профилактики БЛД, в
США, показали улучшение психомоторного развития по сравнению с детьми,
получавшими плацебо (Watterberg K.L. et al., 2007).
Имеются исследования, касающиеся применения еще двух
кортикостероидов у глубоконедоношенных детей для лечения и/или профилактики
хронических заболеваний легких: метилпреднизолона и бетаметазона. Например,
Andre P. et al. (2000) установили, что применение метилпреднизолона также
эффективно у детей, как и дексазона, но не имеет побочных эффектов.
Что касается ингаляционных стероидов, то имеются рандомизированные
исследования (Shah S.S. et al., 2003), демонстрирующие их безопасность и хороший
эффект (экстубация) у детей, находящихся на ИВЛ. Но, к сожалению, нет больших
исследований у новорожденных, не нуждающихся в ИВЛ, что делает невозможным дать
устойчивые клинические рекомендации.
Обсуждаются (Walsh M.C. et al., 2006) и другие лекарственные
препараты, некоторые на стадии клинических испытаний, для лечения и/или
профилактики БЛД, которые могут быть альтернативой стероидам:
– антивоспалительные, такие как супероксиддисмутаза, ИЛ-10,
антагонисты ФНОα, ингаляции оксида азота;
– новые сурфактанты или его компоненты, например, аполипопротеин
В, а также терапевтическая ценность повторных введений сурфактанта в возрасте
10-14 дней;
– секреторный протеин клеток Клара (CC-10);
– блокирующие антитела к бомбезину;
– новые препараты витамина А с высокой биодоступностью, которые
могут быть введены энтерально или парентерально.
Вероятно, некоторые из этих препаратов в ближайшее годы появятся
в клинической практике. В России одно из самых крупных исследований было
проведено Шмаковым А.Н. (2007).
Он обследовал в катамнезе детей, находившихся на отделении
реанимации и интенсивной
Рисунок 65. Катамнез: паталогия ЦНС в возрасте 3 лет (в периоде
новорожденности)
терапии в период новорожденности. Обсследовались дети, родившиеся в
1999-2001 гг. В начале наблюдения было включено в исследование 587 выживших в
неонатальном периоде новорожденных, находившихся в критическом состоянии; выбыло
55; умерло до истечения срока катамнеза 86. Выживаемость 0,76. В 3 года
клинически значимые неврологические нарушения выявлены у 171 из 446. Полученные
данные приведены на рисунке 65. Различие между получавшими дексаметазон или
сочетание дексаметозона и кавинтона не получавшими ни одного из перечисленных
препаратов граничит с достоверным (χ2 = 3,390, р < 0,07). Причина: низкая
чувствительность критерия (0,404) из-за недостаточной численности (требуется 569
наблюдений).
Также за рубежом имеются достаточно много работ, посвященных
применению норадреналина при гипотензии у новорожденных. Например, Derleth D.P. et al.
(1997) установили, что, обладая эффектами адреналина он не вызывает значительной
констрикции коронарных и мозговых артерий. В ряде работ (Bellomo R., Di
Giantomasso D., 2001) подчеркивают, что его инфузия гораздо более эффективна для
стабилизации давления у больных с септическим шоком и выраженной гипотензией,
чем допамина. Имеются рекомендации (Kawczynski P. et al., 1996) по применению
относительно нового синтетического катехоламина допексамина, а у новорожденных
со злокачественной гипотензией при септическом шоке – метиленовой синьки как
ингибитора растворимой гуанилатциклазы (Driscoll W. et al., 1996).
Основные стратегии гемодинамической поддержки у глубоконедоношенных
детей представлены в таблице 121. Они составлены исходя из того, что несмотря на
понимание того, что артериальное давление не отражает в полной мере
гемодинамическую ситуацию, но большинство отделений интенсивной терапии
новорожденных не имеют оборудования, позволяющего оценивать органный кровоток и
все же ориентируются на показатели артериального давления.
Таблица 121. Стратегии гемодинамической поддержки у
глубоконедоношенных новорожденных (Evans N., 2006)
|
Группа детей, причина и основные гемодинамические нарушения
|
Стратегия наблюдения и «порог вмешательства» |
Лечение
|
Комментарии
|
|
Недоношенные дети
< 24 часов жизни |
большой шунт через ОАП |
артериальное давление: вмешиваться, если среднее давление
меньше гестационного возраста |
общее: солевые растворы из расчета
10-20 мл/кг;
решать вопрос
о закрытии ОАП;
1 ст. – добутамин
10-20 мкг/кг/мин
2 ст. – допамин
5-10 мкг/кг/мин
3 ст. – адреналин
0,1-0,5 и/или гидрокортизон
1-2 мг/кг |
титровать
до минимального допустимого АД,
и инфузия должна проводиться
с высокой
скоростью, если САД
низкое |
|
вентиляция
с положительным давлением |
|
сниженный мозговой кровоток |
|
нормальное
или низкое среднее давление |
|
высокое сосудистое сопротивление |
измерение среднего артериального давления и органного
кровотока: вмешиваться, если среднее давление меньше гестационного возраста,
а также
поток в верхней полой вене < 50 мл/кг/мин или выброс крови
правого желудочка
< 150 мл/кг/мин вне зависимости от давления |
общее: солевые растворы из расчета
10-20 мл/кг;
решать вопрос
о закрытии ОАП;
1 ст. – добутамин
10-20 мкг/кг/мин если кровоток
во внутренних органах и давление постоянно низкие:
2 ст. – допамин
5-10 мкг/кг/мин
3 ст. – адреналин
0,1-0,5 и/или гидрокортизон
1-2 мг/кг |
повторить определение кровотока
во внутренних органах; низкий органный кровоток может быть
крайне нечувствительным
к проводимой терапии; титровать вазопрессоры
до минимального допустимого среднего давления
и снижать скорость инфузии быстро, если давление начнет
отклоняться от нормы |
|
Недоношенные
>24 часов |
большой шунт через ОАП |
вмешиваться, если среднее давление меньше гестационного
возраста |
общее: солевые растворы из расчета
10-20 мл/кг;
решать вопрос
о закрытии ОАП;
1 ст. – добутамин
10-20 мкг/кг/мин
2 ст. – допамин
5-10 мкг/кг/мин
3 ст. – адреналин
0,1-0,5 и/или гидрокортизон
1-2 мг/кг, если артериальное давление постоянно низкое |
если используете высокие дозы допамина
или адреналина, убедитесь,
что кровоток во внутренних органах не снижен |
|
сепсис |
|
недостаточность коры надпочечников |
|
нормальный или высокий кровоток
во внутренних органах |
|
низкое среднее давление |
|
вазодилятация |
измерение среднего артериального давления и органного
кровотока: вмешиваться, если среднее давление меньше гестационного возраста |
|
|
Обсуждая инфузионную терапию, невозможно не коснуться вопроса
трансфузии крови и ее компонентов. Немного истории. Как часто мы становимся
«Иванами, не помнящими родства», хотя и в вопросах трансфузии нам есть чем
гордится. Мы относим вышесказанное и к себе, но пытаемся по мере сил с этим в
себе бороться. И надо сказать, что порой сильно изумляешься. Так, недавно
открыли для себя, что, оказывается, впервые в мире белый халат для врачей как
некую «униформу» предложил выдающийся отечественный педиатр Карл Андреевич
Раухфус.
Как известно (Филомафитский А.М., 1847; Еланский Н.Н., 1926),
первые попытки переливания крови в клинической медицинской практике относятся к
середине XVII века, но и в настоящее временя, не до конца решен вопрос о
приоритете в области переливания крови.
Так, Veil E. (1924) (цит. по Багдасарову А.А., 1951) сообщает, что
в 1667 году гамбургский хирург профессор Майор впервые в мире сделал переливание
крови от человека человеку непосредственно из артерии в вену.
В Италии связывают идею переливания крови с именем Франческо Фолли,
предложившим свою методику в 1654 году. Интересно, что хотя Ф. Фолли и не
осуществил свою идею на практике, но в 1935 году при проведении 1 Международного
конгресса по переливанию крови, проходившего в Риме, к дому, где он жил, была
прикреплена мемориальная доска (Шамов В.Н., Филатов А.Н., 1940).
Французские ученые (де Кальве Г., 1925) приписывают приоритет идей
в переливании крови аббату Бурделю (1657) и Роберту де Габе (1658), хотя
известно, что ни тот, ни другой не проверили свои идеи на практике.
Как сообщает А.П. Зильбер (2003) наиболее масштабные исследования в
это время в данной области проводились в Англии, где в 1663 году при Королевском
физиологическом обществе была создана специальная комиссия, изучавшая влияние
гомо-и гетеротрансфузий на собаках, овцах, телятах и т.д. После опытов на
животных переливание гетерогенной крови было сделано человеку, но после первых
удачных исходов стали часто наблюдаться крайне неблагоприятные, обусловленные
видовой несовместимостью. Это быстро привело к тому, что в большинстве стран до
середины XIX века переливание крови людям было запрещено.
В России первым идею о необходимости переливания крови в случае
сильной кровопотери у рожениц высказал С.Ф. Хотовицкий на страницах
«Военно-медицинского журнала» в 1830 году (Хотовицкий С.Ф., 1830). Эта идея была
осуществлена К. Вольфом в СанктПетербурге 20 апреля 1832 года. Он впервые в
России сделал успешное переливание крови родильнице, погибавшей от кровотечения.
Женщина была спасена (Снегерев В.Ф., 1900).
В 1846 году в «Военно-медицинском журнале» появляется обстоятельная
статья Буяльского И.В., посвященная переливаниям крови. Буяльский И.В.
предлагает аппараты, собственной конструкции для переливания, подробно
рассматривает показания для этой операции, предостерегает от продолжения
трансфузии, «если замечается начавшееся возбуждении (reactio) в кровеносной и
нервной системах» (цит. по Снегереву В.Ф., 1900).
В 1848 г. в Москве Филомафитским А.М. был издан «Трактат о
переливании крови». В нем автор собрал сведения из истории переливания крови,
систематизировал представления об этом лечебном методе и привел собственные
обширные экспериментальные наблюдения. Вслед за этим русскими учеными был сделан
ряд диссертаций, посвященной этой проблеме: Сугутин В.В., 1865 (в своей работе
автор практически впервые высказал идею о возвращении крови (реинфузии) в
сосудистое русло больному, более того, именно В.В.Сугутин предложил
консервировать кровь); Раутенберг В.А., 1867; Табуре Н.Н., 1873; Никольский
В.Н., 1880 и др. В этих работах показаниями для переливания служили кровопотеря,
гнойно-септические осложнения, отравления, кахексия и т.д. Интересно, что
Студентский Н.И. в 1874 году рекомендовал пользоваться переливанием крови как
профилактическим средством перед оперативным вмешательством – идея, получившая в
дальнейшем всеобщее признание (Богомолец А.А., 1937).
Несмотря на большое количество исследований, переливания крови в
XIX веке носили единичный характер и были, скорее, казуистикой, чем общепринятым
лечебным мероприятием (Багдасаров А.А., 1933). Связано это было с двумя
обстоятельствами: неумением преодолеть свертывание крови и незнание законов
совместимости.
В конце XIX века возникли попытки химическим путем предохранить
кровь от свертывания. Так, одно из первых предложений принадлежит Раутенбергу
В.А., рекомендовавшему прибавлять к крови углекислый натрий. Афанасьевский С.Н.
в 1884 г. предложил в качестве стабилизатора использовать пептон-соляный раствор
(Виноград-Финкель Ф.Р., 1951). После открытия Шмидта А.А. сущности процессов
свертывания крови стало возможным сознательное изыскание химических
стабилизаторов. Итогом этих изысканий явилось предложение Люисона Р. в 1914 г.
использовать в качестве средства, предохраняющего кровь от свертывания,
лимоннокислый натрий (цитрат) (Гроздов Д.М., 1949). В последующем, несмотря на
предложенные многочисленные стабилизаторы, цитрат стал основным стабилизатором в
трансфузионной практике.
В 1901 г. Ландштейнер К. доказал физиологическое значение реакций
гемоагглютинации как нормальных реакций человеческой сыворотки и установил
групповой характер этой реакции. В 1907 году чешский ученый Яновский предложил
классификацию, разделяющую всех людей по гемоагглютинационным свойствами крови
на 4 группы (Федоровский Г., 1975).
В 1919 году в СССР Шамов В.Н. впервые провел переливания крови с
учетом гемоагглютинационной совместимости крови донора и реципиента. Эти
переливания были произведены в госпитальной хирургической клинике
Военно-медицинской академии, руководимой проф. Федоровым С.П. В 1926 г.
ассистент той же клиники Еланский Н.Н. издал монографию «Переливание крови».
В 1925 году Маслов М.С. в Ленинграде в клинике детских болезней ВМА
впервые в СССР перелил кровь ребенку с учетом гемоагглютинационной совместимости
крови донора и реципиента.
Концепция интраоперационной реинфузии также очень не нова. Считают
(Миротворцев С.Р., 1935), что впервые ее применил в 1818 г. Blundell J. на
собаках. Через 40 лет, в 1865 г., Сугутин В.В. в своей докторской диссертации
высказал идею о возможности возвращения крови в сосудистое русло больному.
Но только в 1886 г. Duncan J. из Эдинбурга перелил 100 мл,
излившейся крови пациенту, оперированному по поводу ампутации нижней конечности.
В том же году и тоже в Эдинбурге Miller K. провел интраоперационную реинфузию
больному с экзартикуляцией инфицированного тазобедренного сустава. В обоих
случаях в виде антикоагулянта использовался цитрат натрия (Спасокукоцкий С.И.,
Брайцев В.Я., 1933).
После этого наступил период достаточного длительного забвения
интраоперационной реинфузии и только в 1914 г. немецкий гинеколог Thies J.
провел успешную реинфузию при операции по поводу внематочной беременности
(Сапожников В.И., 1950). Как сообщает Гудим-Левкович Н.Н. (1952), после этого
реинфузия стала широко внедряться в хирургическую практику. Особенно активно
реинфузией стали пользоваться во время Первой мировой войны. Например, Henry F.
и Elliot R. переливали аутокровь раненым из гемоторакса.
В это время в России активно занимался проблемой реинфузии Филатов
А.Н.. Впервые он применил этот метод в 1918 г. больной с внутрибрюшным
кровотечением при внематочной беременности. За 10 лет, к 1928 г., он провел
реинфузии уже 574 больных. Анализируя полученные результаты, он доказал факт
дефибринирования крови, остро излившейся в серозные полости и ее полную
пригодность для интраоперационной реинфузии в первые часы после кровопотери.
Кроме того, он описал осложнения, возникающие после интраоперационных реинфузий.
Среди них отмечены озноб, рвота, развитие желтухи и даже смертельные исходы
(Филатов А.Н., 1930).
В неонатологии проблема переливания крови, вернее, ее компонентов
стоит достаточно остро из-за большой распространенности анемий. Одно из больших
исследований, посвященное данной проблеме, провел в Санкт-Петербурге Жетишев
Р.А. в 1998-2005 гг.
Остановимся кратко на полученных им результатах (подробно данный
вопрос рассматривается нами в книге «Руководство по интенсивной перинатологии»).
Анализ проводился по материалам отделения реанимации
новорожденных ДГБ № 1
Санкт-Петербурга. Для уточнения частоты анемии, и ее динамики было
изучено 350 историй болезней за 1998 год, 340 – за 1999 год и 542 истории
болезни за 2000 и 2005 гг. Помимо этого, по данным, зафиксированным в журнале
переливаний крови и ее компонентов, уточнялось количество пациентов, которым
была проведена трансфузия ЭМ, а также кратность ее проведения отдельному
ребенку.
С целью определения ведущих причин развития анемии был проведен
детальный анализ 268 историй болезни детей, у которых анемия имела место в периоде
новорожденности. 99 детей находились в отделении в 1999 году и 169 новорожденных
в 2000 году. При этом изучали клиническую картину и проводили оценку
лабораторных показателей крови. Использовались критерии анемии, описанные
Шабаловым Н.П. (1995).
Проведенное исследование показало, что анемия в периоде
новорожденности в 1998 г. отмечена у 68% детей, в 1999 – у 67,4%, в 2000 году –
у 66,1% и 2005 – у 65% больных.
Дети по сроку гестации распределились следующим образом (таблица
122).
Условно, в зависимости от срока гестации, все дети были
распределены на три группы:1-я – доношенные дети, 2-я – недоношенные, срок
гестации которых 33 недели и больше, 3-я – недоношенные дети, 32 недели и
меньше. Соответственно, количество детей в каждой группе:
79 (29,5%), 66 (24,6%) и 123 (45,8%). Таким образом, большая часть
детей с анемией вошла в 3-ю группу – глубоконедоношенных детей.
Таблица 122. Гестационный возраст пациентов с анемией (Жетишев
Р.А., 2003)
|
Срок гестации
|
Число детей
|
% (от общего числа)
|
|
25
|
1
|
0,37
|
|
26
|
2
|
0,75
|
|
27
|
12
|
4,48
|
|
28
|
11
|
4,10
|
|
29
|
21
|
7,84
|
|
30
|
22
|
8,2
|
|
31
|
22
|
8,2
|
|
32
|
32
|
11,94
|
|
33
|
23
|
8,58
|
|
34
|
18
|
6,72
|
|
35
|
16
|
5,97
|
|
36
|
9
|
3,36
|
|
Доношенные
|
79
|
29,48
|
|
Итого
|
268
|
100
|
Как видно из таблицы 122, в большинстве случаев анемия в
неонатальном периоде была диагностирована у недоношенных детей (70,5%).
Наибольшая частота анемии была отмечена у прооперированных
новорожденных – 79 детей (29,7%), у больных с генерализованной инфекцией
(внутриутробная и постнатальный сепсис) – 39 детей (14,7%), и при гемолитической
болезни новорожденного – 19 детей (7,2%). Важно отметить большое количество
больных (36,5%), при анализе историй которых причину развития анемии уточнить не
удалось.
Проведено исследование для того, чтобы уточнить какие
патологические состояния, сопровождающиеся развитием анемии, отмечаются в
группах детей с различными сроками гестации (см. таблицу 123).
Таблица 123. Структура основных причин развития анемии в
зависимости от срока гестации (Жетишев Р.А., 2003)
|
Патологический фактор
|
Группа 1
|
Группа 2
|
Группа 3
|
|
абс.
|
%
|
абс.
|
%
|
абс. |
%
|
|
Оперативное вмешательство |
41
|
51,9
|
14
|
20,3
|
25 |
20,8
|
|
ВУИ |
6
|
7,6
|
9
|
13,0
|
18 |
15,0
|
|
ГБН по Rh |
6
|
7,6
|
0
|
0
|
0
|
0
|
|
ГБН по АВО |
4
|
5,1
|
3
|
4,4
|
6
|
5
|
|
Желудочно-кишечное кровотечение |
2
|
2,5
|
1
|
1,5
|
3
|
2,5
|
|
Сепсис |
1
|
1,3
|
0
|
0
|
5
|
4,2
|
|
Фето-плацентарная трансфузия |
1
|
1,3
|
2
|
2,9
|
5
|
4,2
|
|
Фето-фетальная трансфузия |
0
|
0
|
1
|
1,5
|
1
|
0,8
|
|
ВЖК 3-4ст. |
0
|
0
|
0
|
0
|
16 |
13,3
|
|
Причина не уточнена |
18
|
22,7
|
39
|
56,4
|
41 |
36,7
|
|
Всего детей данной группы |
79
|
100
|
69
|
100
|
120 |
100
|
У доношенных детей наибольшая частота анемии отмечалась в группе
прооперированных детей (51,9%) и при ГБН (12,7%). У недоношенных новорожденных
со сроком гестации более 32 недель также был высок процент больных с анемией,
после оперативного вмешательства (20,3%), но на втором месте были новорожденные
с внутриутробной инфекцией (13%). В группе недоношенных детей со сроком гестации
32 недели и меньше анемия отмечена у 20,8% прооперированных больных, имелся
существенный рост в сравнении с другими группами детей, доли внутриутробных
инфекций и сепсиса, внутрижелудочковых кровоизлияний и фето-плацентарных
трансфузий.
Проведен анализ для уточнения времени появления анемии (рисунок
66).
Из общего числа детей (268) развитие анемии в раннем неонатальном
периоде отмечено у 49,5% новорожденных. У 24,5% новорожденных анемия впервые
диагностирована на второй недели жизни, на 3-й неделе – у 14,1%, и на 4-й – у
11,9%. При появлении анемии на 3-4 неделе жизни число недоношенных детей было
значимо больше по сравнению с первыми неделями (83,4 и 68,2% соответственно).
Отмечался существенный рост числа детей с не уточненной причиной анемии при
более позднем ее развитии, в особенности в группе глубоконедоношенных детей (с
14,6 до 86,3%). К окончанию неонатального периода у 8,3% детей имелась тенденция
к снижению средней концентрации гемоглобина в эритроците (ниже 31 пг) с
одновременным относительным уменьшением среднего объема эритроцита (ниже 92 фл).
Большую часть данных больных составляли глубоконедоношенные дети (80%),
остальные – новорожденные, прооперированные по поводу врожденной аномалии
желудочно-кишечного тракта и порока сердца.
Рисунок 66. Время появления анемии у новорожденных детей отделения
реанимации (Жетишев Р.А., 2003)
При изучении потребности в переливании эритроцитной массы по поводу
анемии было отмечено, что в 1998 году в отделение реанимации новорожденных детей
поступило 605 детей, из которых переливание ЭМ было проведено 28,8% детей, в
1999 году в отделении находилось
625 пациентов, трансфузия ЭМ сделана 21,6%, в 2000 году из 609
новорожденных переливание проведено 21,3% новорожденных, а к 2005 году из 546
детей – 24,1%.
Таким образом, в 1999 году по сравнению с 1998 годом уменьшилось
количество детей, которым было проведено переливание ЭМ. В 2000 году эта
величина существенно не изменилась по сравнению с предыдущим годом, а затем
снова немного повысилась.
Общая частота трансфузий, в отличие от количества пациентов,
которым была проведена трансфузия ЭМ, значимо уменьшалась с каждым годом
(соответственно, 237, 193, 167, 134). Снижение частоты переливаний происходило в
основном за счет уменьшения числа повторных трансфузий ЭМ.
Наибольшая частота и объем переливаний ЭМ были проведены в первую
неделю жизни. У прооперированных детей эти показатели были выше. В зависимости
от срока гестации частота трансфузии ЭМ менялась (у доношенных – в 42,1%
случаев, у недоношенных со сроком гестации больше 32 недель – в 43,6% и у
глубоконедоношенных – в 52,1%). Такая же зависимость отмечена и при анализе
объема трансфузии ЭМ (от 14,8 мл/кг массы тела одному пациенту у доношенных
детей, до 29 мл/кг массы – глубоконедоношенным).
Таким образом, у новорожденных реанимационного отделения выявлена
большая частота развития анемии, с максимумом в первую-вторую недели жизни.
Уточнены состояния, при которых анемия развивается чаще. Исследованы ведущие
причины развития ее в зависимости от срока гестации детей. Выделены группы
максимального риска по проведению трансфузий ЭМ. Отмечено, что в отделении,
несмотря на снижение частоты трансфузий ЭМ, еще имеется резерв для уменьшения
данного показателя.
К концу периода новорожденности у 8,3% детей, имеющуюся анемию,
можно связать с дефицитом железа. Предрасполагающими для этого факторами
являются тяжелые операции и гестационный возраст меньше 30 недель.
Подводя итог данному исследованию, необходимо акцентировать
внимание на некоторых важных моментах:
1. Частота анемии у новорожденных, находящихся в отделении
реанимации, высока и составляет в среднем 67%.
2. Чаще всего анемия развивается у недоношенных детей – 70,5%
от общего количества детей с анемией, причем 45,6% составляют дети со сроком
гестации менее 33 недель.
3. В 74% случаев анемия отмечается в первые две недели жизни, и
в 49,5% – в течение первой недели жизни.
4. Чаще анемия развивается у прооперированных новорожденных, у
больных с ВУИ и неонатальным сепсисом, при ГБН и ВЖК (90,7% из числа уточненных
случаев анемии).
5. Ведущие причины развития анемии отличаются в зависимости от
срока гестации и времени ее появления.
6. Трансфузии ЭМ проводятся в среднем каждому третьему пациенту с
анемией. У детей, потребовавших выполнения оперативного вмешательства, частота
переливаний выше и составляет 58,4%.
Большая часть переливаний ЭМ происходит в первые две недели
жизни.
Обнаружен высокий процент детей с не уточненной причиной анемии,
что указывает на недостаточное внимание к данному синдрому.
Для уточнения причины развития анемии, ее характера, в особенности
у недоношенных новорожденных, проведено дополнительное исследование 89 детей.
При этом было обнаружено, что у подавляющего большинства новорожденных в первые
2 недели жизни отмечалась гиповолемия в сочетании с анемией. У 78,6%
больных имелось снижение ОЦК более чем на 10%. При оценке количества крови,
забираемого на анализы в течение неонатального периода у этих детей, выяснилось,
что они составляли в среднем 11,7±1,3 мл/кг, а у недоношенных с сепсисом
достигали 22,7±1,9 мл/кг. Максимальные потери отмечались в первую
неделю жизни (в среднем 48,5%). Во 2-ю неделю флеботомические потери составили
26,4% и в последующие 2 недели только 25,1%. Объем забираемой крови был выше у
детей, находившихся на ИВЛ, и зависил от продолжительности вентиляции. Был также
проведен анализ количества крови, переливаемой детям в течение неонатального
возраста. Обнаружено, что в 1-ю неделю жизни переливали
24,4% от общего количества ЭМ, перелитой за 28 дней жизни. Во 2-ю
неделю – 23,7% и в последующие 2 недели – 47,9%. Обнаружена диспропорцию между
объемом флеботомических потерь в первые 2 недели жизни и величиной перелитой ЭМ
за этот же период времени. То есть в первые две недели жизни объем крови,
забираемый на анализы, превышал объем переливаемой ЭМ. Был проведен
статистический анализ, показавший сильную отрицательную корреляционную связь
между уровнем гемоглобина в крови и объемом флеботомических потерь у детей
первых 2-х недель жизни (R = –0,72, p < 0,02). Таким образом,
гиповолемический характер анемии у большинства недоношенных новорожденных
отделения реанимации был обусловлен большими флеботомическими потерями,
превышающими объем перелитой эритроцитной массы и плазмы.
Показания для проведения трансфузии эритроцитарной массы с
целью коррекции анемии у новорожденных детей
Как отмечает Жетишев Р.А. (2003), на протяжении ряда лет
единственным способом лечения тяжелой анемии при РАН являлась трансфузия цельной
крови или эритроцитной массы. До настоящего времени трансфузия ЭМ при тяжелой
анемии является основным методом терапии РАН.
Однако либеральная политика при решении вопроса о необходимости
проведения трансфузии ЭМ увеличивает частоту и объем переливаний. Это же, в свою
очередь, приводит к подавлению эндогенной продукции ЭП и эритропоэза. В связи с
этим при проведении Жетишевым Р.А. вышеописанных исследований использовались
единые критерии для проведения трансфузии ЭМ при развивающейся анемии.
Используемые показания – модификация рекомендаций Sola А. (1997, 2003), основой
которой являются канадские и американские рекомендации по переливанию крови
новорожденным детям (Messer J. et al., 1993; Messer J. et al. 1998; Donato H. et
al., 2000).
Рекомендации по переливанию ЭМ
Определение гематокрита. Обычно капиллярный гематокрит выше
венозного (разница до 10%), поэтому перед переливанием, если гематокрит
меньше 30% и у ребенка нет других симптомов анемии, следует проверить
венозный гематокрит.
I. Гиповолемический шок, острая кровопотеря, неонатальный сепсис
В этой ситуации определение гематокрита не имеет большого значения,
поэтому используются клинические критерии, и переливают эритроцитную массу
быстро, пока ребенок не станет нормоволемичным.
II. Респираторный дистресс-синдром (РДС)
III. Стабильный растущий недоношенный
а) Переливание показано при HCT < 20% и количестве ретикулоцитов
менее 100 тыс в1 мкл. или меньше 2% даже при отсутствии любой другой
симптоматики.
б) Переливание показано, если HCT < 25% и имеются какие-либо из
следующих симптомов:
– потребность в кислороде > 24%, и поток кислорода > 0,25
л/мин;
– появление или усиление тяжести эпизодов апноэ и брадикардии
(10-12 эпизодов за 12 часов, и 2 эпизода в сутки соответственно), требующих
проведения ИВЛ, эти эпизоды не должны быть связаны с другими причинами и нечувствительны к
применению метилксантинов;
– тахикардия > 170-180 или одышка > 70-80 в 1 минуту в течение 24
часов, ранее не имевшаяся и не связанная с другими причинами;
– снижение прибавки веса менее 10 г в день в течение 4 дней при
оптимальном каллораже 120 ккал/кг в сутки.
IV. У хирургических больных до и/или после операции –
переливать при Ht < 30%.
V. При врожденных пороках сердца – переливать при HCT < 40%,
при ДМЖП с шунтом, слева направо – переливать при гематокрите < 55%.
Объем переливаемой ЭМ
1. При HCT < 30% – 10 мл/кг за 4 часа, повторить через 12 часов, после
второго переливания проверить гематокрит.
2. При HCT > 30% – 10 мл/кг за 4 часа, затем перепроверить
гематокрит.
Следующий вопрос: куда проводить инфузию или трансфузию? И вот
здесь мы сталкиваемся с существенной проблемой неонатологии – парентеральным
введением растворов и лекарственных препаратов. Мы полностью согласны с мнением
Рюминой И.И. и соавт. (2005): «Несмотря на то что любое инвазивное
вмешательство, а внутривенная терапия, у новорожденных в особенности, связана с
высоким риском, следует отметить, что при лечении новорожденных чаще, чем в
других возрастных группах пациентов, встречается избыточное и необоснованное
назначение лекарственных средств, необоснованный выбор инъекционного пути
введения препаратов, а также осложнений инъекций вследствие технических
трудностей или нарушения правил проведения инъекций. Широко распространенное
внутримышечное введение препаратов в неонатологической практике должно быть
максимально ограничено в связи с выраженным болевым синдромом (от себя отметим,
что выдающийся педиатр современности Воронцов И.М. подчеркивал – одна
внутримышечная инъекция новорожденному ребенку может изменить восприятие боли на
всю оставшуюся жизнь), который оказывает существенное влияние на общее состояние
ребенка, а также в связи с опасностью повреждения нервных стволов при выполнении
процедуры». В связи с этим авторы сформулировали принципы безопасной
инъекционной практики в неонатологии:
– определение оптимального места инъекции, дозы и объема
препарата;
– уменьшение болевых ощущений при проведении инъекции;
– использование игл, катетеров соответствующего размера;
– исключение повторного использования одноразового расходного
материала (игл, шприцев, катетеров, линий и т.д.);
– следование правилам асептики и антисептики (правильное мытье
рук, обработка места инъекций, приготовление растворов в стерильных условиях);
– теоретическая и практическая подготовка, а также периодическое
повышение квалификации медицинского персонала;
– фиксирование в истории болезни всех осложнений, связанных с
инъекциями;
– предотвращение внутрибольничного распространения
гемоконтактных инфекций;
– соблюдение медицинским персоналом правил безопасности при
проведении инъекций. NB. Отметим еще один немаловажный момент: если у
больного имеются нарушения периферической гемодинамики, то внутримышечные
инъекции просто бессмысленны, потому что
лекарственный препарат в кровоток не поступит.
На наш взгляд, желательно, чтобы на отделении реанимации и/или
интенсивной терапии оценивали степень болезненности тех или иных процедур. Для
этого могут быть использованы различные шкалы. В главе 5 приведена шкала,
разработанная одним из авторов данной книги Шмаковым А.Н. В приложении 19
приведены шкалы, использующиеся за рубежом.
Понятно, что для введения больших объемов инфузии нужен постоянный
венозный доступ. Обеспечение венозного доступа должно быть осуществлено до
начала транспортировки больного исходя из стандартов, принятых в конкретном
регионе.
Таблица124. Типы катетеров, используемых в
отделениях интенсивной терапии и реанимации новорожденных (данные Бойковой М.В.,
2000, с изменениями)
|
Тип катетера
|
Показания
|
Осложнения
|
Место постановки
|
Сестринский уход
|
Растворы
|
|
Периферич. венозный катетер, тефлоновая канюля
19-24 G размера; ставится процедурной медицинской сестрой |
Используется для введения лекарств и парентерального питания,
инфузий жиров
и растворов глюкозы < 12,5 %, для переливания крови
и плазмы |
Инфильтрат, флебит, нарушение проходимости катетера Возможна
экстравазация |
Последовательно от мелких периферических вен к более крупным,
т.к. вена может быть использована повторно.
Не ставить в вены головы ниже линии волосяного покрова |
Наблюдение за конечностью, в которой находится катетер: каждый
раз при введении лекарств или переливании крови, или каждый час. При
появлении покраснения,
отека, припухлости или утечки катетер следует удалить. При
закреплении катетера необходимо учитывать возможность наблюдения за
вовлеченной конечностью |
Раствор глюкозы ≤ 12,5%;
растворы аминокислот ≤ 2%; растворы кальция
≤ 400 мг/100 мл |
|
Cиликоновый катетер (линия), ставится процедурной медицинской
сестрой |
Используется для длительного парентерального питания, введения
жиров, лекарств. Может быть перифери ческой или центральной. Не может быть
использована для переливания крови или кровезаменителей и инфузии дилантина.
Не рекомендуется также использовать для взятия крови на анализы.
Нельзя использо вать
для струйного введения растворов шприцы большого объема
(10,20,50 мл) |
Центральная линия: сердечные аритмии, венозный застой
катетеризированной конечности, нарушение проходимости катетера.
Периферическая линия-инфильтрат, флебит, нарушение проходимости катетера |
Центральная линия: конец катетера должен находиться в верхней
полой вене у входа
в правое предсердие, в подключичной или в яремной вене, если
катетер поставлен с верхних конечностей или с вен головы. Конец катетера
должен находиться в нижней полой вене на уровне диафрагмы,
если катетер поставлен с ноги. Место постановки должно быть
подтверждено рентгенконтрастным исследованием. Количество контраста –
0,5 мл с учетом заполнения иглы-«бабочки», если линия не
длиннее 35 см |
Оценивать правильность фиксации, проверять место введения на
признаки инфицирования, экссудата. Если катетер периферический, контроль за
появлением признаков отека, флебита. Переклеить пластырь, если закрепление
его ненадежно. Для посева линии: отрезать кусочек линии стерильными
ножницами, поместить
в стер. контейнер со средой и отправить в лабораторию.
В историю болезни необходимо записывать, сколько было отрезано
от линии для посева или при устранении протечки в линии, или сколько
сантиметров было подтянуто после контрастирования |
Центральная линия:
нет лимита концентрации глюкозы, в центральный катетер можно
производить одновременно инфузию допамина, в/в растворов для парэнтерального
питания и жировых эмульсий. Периферическая линия: ограничения такие же,
как для периферического катетера. Все силиконовые катетеры
требуют гепаринизации (0,1 ед. гепарина на 1,0 мл вводимой жидкости, если
скорость инфузии превышает
2,0 мл в час, и 0,5 ед. гепарина на 1,0 мл вводимой жидкости,
если скорость инфузии менее 2,0 мл
в час |
Продолжение таблицы 124
|
Тип катетера
|
Показания
|
Осложнения
|
Место постановки
|
Сестринский уход
|
Растворы
|
|
Пупочный артериальный катетер (размер
3.5, 5 Fr), ставится врачом |
Катетер выбора для взятия крови на КЩР и мониторинга
артериального давления
у детей с момента рождения до 1 недели жизни. Детей
со стоящим артериальным пупочным катетером не рекомендуется
кормить |
Снижение перфузии в нижних конечностях и ЖКТ: может развиться
некроз тканей. Воздушная эмболия. Быстрая
и большая кровопотеря при негерметичности систем проводников.
Все пупочные артериальные катетеры должны быть подсоединены
к монитору измерения прямого АД. Необходимо отметить, что
артерии вскоре после катетиризации особенно предрасположены
к спазму, что может потребовать удаления катетера |
Конец катетера должен находиться в аорте на уровне L3-L4.
Местонахождение катетера должно быть подтверждено рентгеновским снимком |
Контроль безопасности
и герметичности соединений, осмотр пупка, наблюдение
за перфузией на ягодицах и ногах, проверка пульса
на бедренной артерии и артерии стопы. Об изменении цвета нижней
половины тела
и конечностей немедленно сообщать врачу. Катетер должен быть
удален, если симптомы ухудшения перфузии присутствуют в течение 10 мин
и не исчезают. Пульсовая волна на мониторе измерения прямого
артериального давления не должна быть сглаженной, а должна иметь пики,
присущие нормальной сфигмограмме. Пациентов
с артериальным пупочным катетером не рекомендуется класть на
живот из-за опасности кровотечения. Для того чтобы удалить катетер,
необходимо прекратить вливание физиологического раствора NaCl, вытянуть
катетер до отметки 3 см, дождаться исчезновения пульсации в катетере и
удалить его. После удаления катетера существует опасность кровотечения! |
Для введения лекарственных средств не используется.
Обязательно постоянное микроструйное введение гепарина на
физиологическом растворе NaCl (в 1 мл – 1 ед.) со скоростью не более 1 мл в
час |
|
Венозный пупочный катетер, ставится врачом |
Катетер выбора для забора крови и инфузии растворов
в течение первой недели жизни. Детей с катетеризированной
пупочной веной не рекомендуется кормить |
Осложнения такие же, как при катетеризации пупочной артерии, но
риск снижения перфузии нижних конечностей меньше. Риск развития портальной
гипертензии. Возможна экстравазация |
Конец катетера должен находиться в нижней полой вене на уровне
диафрагмы. Местонахождение катетера обязательно подтверждается
рентгенологически |
Необходимо постоянное наблюдение за ребенком,
т.к. существует опасность кровотечения из пупочной вены! |
Нет лимита концентрации глюкозы, в центральный катетер можно
производить одновременно инфузию допамина, в/в растворов для парэнтерального
питания и жировых эмульсий |
Окончание таблицы 124
|
Тип катетера
|
Показания
|
Осложнения
|
Место постановки
|
Сестринский уход
|
Растворы
|
|
Катетер
диаметром 0,6 мм. Ставится врачом катетеризацией центральных
вен по Сельдингеру. Катетеризация периферических
вен осуществляется процедурной медицинской сестрой. Возможна
секционная постанов
ка врачомхирургом |
Используется у пациентов,
у которых нет других возможностей венозного доступа,
и которым не нужен Broviac. Одним из показаний для постановки
может служить необходимость контроля ЦВД. Время использования
периферического катетера – не более 2-3 суток |
Инфицирование места постановки, инфильтрат, тромбофлебит,
нарушение проходимости катетера. Возможна экстравазация |
Место постановки зависит от типа катетера: следовать
руководству для центральных и периферических катетеров. Место постановки
центрального катетера должно быть подтверждено рентгенконтрастным
исследованием |
Следить за состоянием швов
и местом постановки катетера на признаки инфицирования и отека.
Остальное наблюдение такое же, как и за всеми центральными и периферическими
катетерами |
Предельная концентрация вводимых растворов зависит от типа
катетера: центральный или периферический |
|
Периферический артериальный катетер,
тефлоновая канюля
22-24 G, ставится процедурной медсестрой
или врачом |
Используется у пациентов при невозможности катетеризации
пупочной артерии. Используется для взятия пробы на газовый состав крови.
Может использо ваться для мониторинга артериального давления |
Снижение перфузии
в вовлеченной конечности, опасность кровотечения. Все
периферические артериальные катетеры должны быть подключены к монитору
измерения прямо-
го АД |
Катетеризируется лучевая артерия. Лучше использовать катетеры
Jelco или Insyte |
Оценивать перфузию в вовлеченной конечности, безопасность
соединений систем
и тройников, в периферическую артерию не рекомендуется вводить
глюкозу. Следует наблюдать за пульсовой волной на мониторе. Промывание
катетера может вызвать спазм или эмболию сосуда. Рекомендуется менять
системы
для вливания и переходники по необходимости во избежание
тромбоза и эмболии |
В периферический артериальный катетер нельзя вводить лекарства
и глюкозу, кроме раствора для промывания: на 1 мл
0,9% раствора NaCl 1ED
гепарина со скоростью
1 мл/час |
Для проведения инфузионной терапии у новорожденных детей могут
использоваться следующие венозные доступы (см. таблицу 124).
Поскольку в нашей стране в настоящее время большинство регионов
используют внутривенные линии, то в приложении 10 представлена методика
постановки линии, представленная Паршиным Е.В.
Заметим, что слово «линия» – это сленг, употребляемый в России. В
англоязычной литературе все катетеры называются линиями (arterial line, venous
line, central line etc.). Вообще это называется ПЦВК (периферически вводимый
центральный венозный катетер) или PICC line (Peripherally Inserted Central
Catheter). Центральная линия – это любой катетер в центральной вене: ПЦВК,
подключичный, яремный, бедренный – неважно. Осознавая этот факт, мы будем в
своем изложении применимо к ПЦВК пользоваться словом «линия». Считаем
необходимым отметить, что, конечно, любая катетеризация представляет собой риск,
связанный с развитием осложнений. Наверное, этот вопрос также нуждается в
дальнейших исследованиях, потому что данные, приводимые в литературе, достаточно
сильно отличаются. По данным многочисленных наблюдений, как у нас в стране, так
и за рубежом наименьшее количество осложнений наблюдается при катетеризации
центральных вен через периферические (постановка линий). Например, Духовников
О.К. (2005) указывает, что осложнения при постановке линий наблюдались у 4,8%
детей в виде местных флебитов периферических вен, быстро проходящих после
удаления катетера. Для сравнения: при катетеризации пупочной вены осложнения
составили
22,7%. Среди них отмечались очень серьезные: распространенный
сосудистый спазм, некротический энтероколит, тромбоэмболия легочной артерии и
т.д.
Cartwright D.W. в 2004 году опубликовал данные большого
исследования, посвященного осложнениям, связанным с линиями. Были
проанализированы данные за 18 лет. В исследование было включено 1862 младенца.
Общее время нахождения линий у всех детей, включенных в исследование, составило
35 159 дней (медиана 14 дней, диапазон = 1-99 дней). Среди осложнений основным
была септицемия (5,3% новорожденных). Хотя авторы отмечают, что вполне возможно,
не все случаи септицемии связаны с катетерами. Был один случай (0,05%) выпота в
полость перикарда, обусловленный постановкой линии. Ребенок выжил.
С другой стороны, Ainsworth S.B. et al. (2001) опубликовали
результаты рандомизированного исследования по сравнению частоты осложнений,
прежде всего инфекционных, встречающихся при постановке линий и периферических
катетеров (канюль). Было показано, что использование линий более
предпочтительно, но связано ни с инфекционными осложнениями, прежде всего
сепсиса, их частота в группах не отличалась: 46% новорожденных заболели сепсисом
в группе детей с линиями и 40% – с канюлями. А вот эффективность парентерального
питания, оцененная по потере массы тела, была гораздо выше в группе детей с
линиями. Нас, честно говоря, удивляет высокая частота сепсиса в данном
исследовании и представляется, что вряд ли этот сепсис всегда был
посткатетеризационным. Да и группы очень небольшие: всего-то 49 новорожденных.
Хотя и в более ранних работах (Trotter C.W.,
1996) указывалось на высокую, хотя и меньшую, частоту
линий-ассоциированного сепсиса – до 29%, в среднем 15,3 случая на 1000
«линий-дней» поставленных линий. Чуть большую частоту линий-ассоциированного
сепсиса обнаружили и другие исследователи (Kelly R.E. et al.,
1997; Corral G.M. et al. 1999). Заметим, что
эксперты национального центра по контролю за болезнями США (O’Grady N.P. et al.,
2002) и Системы надзора за назокомиальными инфекциями США (National Nosocomial
Infections Surveillance System) сообщают, что при нахождении пупочного катетера
частота катетер-ассоциированного сепсиса составляет от 3,5 до 3,8 случаев на
1000 «катетер-дней» у детей с массой более 2500 г при рождении и от 9,1 до 11,3
случаев у детей с массой тела = 1000 г при рождении.
Частота механических осложнений (смещение, транссудация, окклюзия,
флебит, плевральный выпот), требующие удаления катетера, по разным данным (Durand
M. et al., 1986; Sigda M., et al., 1992; Kelly R.E. et al., 1997), встречаются с
частотой от 26 до 39%. Пупочный
катетер, по разным данным (Evans M., Lentsch D., 1999;
Butler-O’Hara М. et al., 2003), по аналогичным показаниям удаляется в 14-33%
случаев.
Иногда постановка линии, особенно у глубоконедоношенных детей,
требует длительного времени и необходимо помнить в этот момент, что ребенок
может сильно охладиться.
Еще на одно осложнение, связанное с линиями, указывают Beardsall K.
et al. (2003). Речь идет о выпоте в перикард с последующей тампонадой сердца.
Они проанализировали 44 000 случаев постановок линий. При этом оказалось, что выпот в
перикард встречается с частотой 1,8 : 1000 линий, а летальность при этом
достигает 30-50%, со средней частотой
0,7: 1000 линий. Имеются сообщения и о более высокой частоте (до
3%), указанных осложнений (Leipala J.A. et al., 2001; Beardsall K. et al.,
2003). По нашему опыту, частота подобных осложнений гораздо меньше. Тем не менее
нельзя забывать, что любой катетер, в том числе и линия, требуют контроля
(рентгенологического) и ухода (см. таблицу 125).
Что делать, если нет линий? Использовать пупочные катетеры. Как?
(Невольно слышим мы изумленный возглас, ведь использование пупочного венозного
катетера может привести к серьезным осложнениям, включая тромбоз, эмболию,
кровотечение, аритмии, выпоты, портальную гипертензию и т.д.) У нас в стране
очень часто говорят, что в западных странах их не используют. Это не так.
Используют достаточно часто и длительно. Например, Tiffany K.F. et al. (2003)
указывают, что реальная частота использования пупочных катетеров в отделениях
реанимации и интенсивной терапии новорожденных в США гораздо выше той, которая
обычно указывается в учебниках по неонатологии, и достигает 99%. Loisel D.B. et
al. еще в 1996 году в проспективном рандомизированном исследовании, сравнивая
группы детей, имеющих внутривенные линии и пупочные катетеры, пришли к
заключению, что младенцы, имеющие пупочный катетер в течение 2 недель жизни (!),
требуют проведения гораздо меньшего количества венопункций и повторных
постановок линий. При этом сепсис и другие осложнения встречались с одинаковой
частотой в обеих группах. Правильная постановка пупочного катетера с первого
раза зарегистрирована в 70% случаев, а линии – в 46%. Таким образом, авторы
отмечают, что пупочный катетер, используемый в течение 3 недель – относительно
безопасное и рентабельное средство для обеспечения внутривенной терапии
новорожденных.
Таблица 125. Принципы ухода за венозными линиями (Cartwright D.W.,
2004)
|
1. Осуществлять постановку катетера должен только опытный
персонал |
|
2. Необходимо ввести катетер достаточно далеко, но отвести от
стенки сосуда |
|
3. Не оставляйте катетер в том месте, где нет легкого и
повторного оттока крови через него |
|
4. Всегда вводите рентгеноконтрасное вещество для контроля
положения катетера (если вы этого не делаете, то вы не знаете, где находится
кончик катетера) |
|
5.Вводите контраст во время рентгенологического обследования,
чтобы видеть, как вещество выходит из кончика катетера |
|
6. Соблюдайте стерильность при постановке или смене линий |
|
7. Не вводите лекарственных препаратов – катетер используйте
только для парентерального питания |
|
8. Проводите антигрибковую профилактику путем орального или
системного введения нистатина |
|
9. Покройте место инъекции повязкой и оставьте катетер в покое.
Не оставляйте виток катетера под повязкой |
Эксперты национального центра по контролю за болезнями США (O’Grady
N.P. et al.,
2002) рекомендуют, чтобы использование пупочных венозных катетеров
не превышало 14 дней (см. приложение 11). Но исследование Tiffany K.F. et al.
(2003) показало, что многие врачи в США используют пупочный катетер более
длительно. Эти наблюдения привели к тому, что Butler-O’Hara М. et al. (2006) из
Нью-Йорка провели рандомизированное сравнительное исследование, касающиеся
осложнений при кратковременном (менее 7-10 сут. жизни) и долговременном (до 28
суток жизни) нахождении катетера в пупочной вене у детей с массой тела менее
1251 г. Результаты были опубликованы в 2006 году, а само исследование
проводилось с 1998 по 2004 гг. Результаты их работы представлены в таблице 126.
Таблица 126. Осложнения у детей при долговременном и
кратковременном нахождении пупочного катетера (Butler-O’Hara М. et al., 2006)
|
Пупочный венозный катетер
|
|
|
≤ 7-10 суток
|
до 28 суток
|
р
|
|
Количество обследованных |
106
|
104
|
|
|
Количество смен катетеров |
1,98 ± 0,63
|
1,74 ± 0,75
|
0,01
|
|
Частота инфицированности катетера |
14 (13)
|
21 (20)
|
0,17
|
|
Количество дней до инфицированности катетера |
11,5 (5–25)
|
14 (5–28)
|
0,35
|
|
Количество детей с тромбами катетера |
10 (9)
|
14 (13)
|
0,36
|
|
Количество детей с клинически значемыми тромбозами |
4 (4)
|
7 (7)
|
0,34
|
|
Количество детей с перикардиальным выпотом |
11 (10)
|
10 (10)
|
0,85
|
|
Частота ЯНЭК |
7 (7)
|
11 (11)
|
0,30
|
|
Количество дней до полного питания |
23 (7–101)
|
22 (7–136)
|
0,84
|
|
Количество дней до восстановления веса |
9 (0–27)
|
10 (0–33)
|
0,71
|
|
Умерло детей |
8 (8)
|
7 (7)
|
0,82
|
Примечание. Среднее ± SD, n (%), или среднее (диапазон
колебаний).
В принципе, выводы читатель может сделать сам, но укажем на
заключение авторов: не найдено никаких различий (по количеству инфекционных и
неинфекционных осложнений) между группами. Дети осмотрены в катамнезе через 1
год (предполагается более длительное наблюдение, по крайней мере до 5 лет). Один
ребенок из группы с длительным нахождением катетера имел холестатический гепатит
без признаков портальной гипертензии.
С другой стороны, комментируя эти исследования, возникает мысль,
что американские врачи могут «прятать» портальную гипертензию так же, как они
«прячут» регистрацию пупочных венозных доступов. Для них это жизненно важный
финансовый вопрос. Мы снова сталкиваемся с необходимостью проведения системных
исследований в собственной стране, конечно, учитывая зарубежный опыт.
В приложении мы приводим методику постановки пупочного катетера:
под УЗ-контролем, последующим контрастированием и рентгеновским подтверждением
места нахождения кончика и т.д.
Резюмируя, можно сказать одно: если ребенок нуждается в
проведении инфузионной терапии, но нет линии, не надо отчаиваться,
используйте пупочный катетер!
Как известно, периодические ошибки внутривенного введения жидкостей
и препаратов неизбежны. В связи с эти в справочнике «Современная терапия в
неонатологии» (2000) указаны десять золотых правил, снижающих опасность
внутривенных инфузий. Считаем необходимым привести их полностью:
1. Сведите к минимуму назначения лекарственных препаратов, при
возможности вводите их 1-2 раза в день.
2. При отсутствии абсолютной необходимости никогда не проводите
инфузию ребенку более чем через 2 внутривенных линии в одно и то же время.
3. Не набирайте одновременно более 30 мл любой жидкости в любой
шприц, который используется для продолжительной инфузии препаратов или кормления
новорожденного с массой тела менее 1000 г.
4. Каждый час записывайте количество введенной через каждый
шприцевой насос внутривенно жидкости, наблюдая за движением шприца и проверяя место
инфузии.
5. При проведении инфузии с использованием большого (500 мл) резервуара с
применением перистальтического насоса (или капельницы с пережимающим
клапаном и счетчиком капель) благоразумно поместить бюретку между основным
резервуаром и контрольной частью. Ограничение количества жидкости в бюретке
приведет к снижению опасности внезапной перегрузки жидкости, подсчет
количества жидкости, остающийся каждый час в бюретке, ускорит выявление любых
ошибок введения.
6. Кроме редких причин, не меняйте режим кормления или
инфузионной терапии более чем 1-2 раза в день. Попытайтесь приурочить эти изменения к
утреннему или вечернему обходу.
7. Не «прогоняйте» введенный во внутривенную линию препарат или
жидкость путем временного изменения скорости работы шприцевого насоса.
Существует опасность не только того, что шприцевой насос не будет возвращен к
прежнему режиму работы, но небезопасно и болюсное введение ребенку с
нормальным уровнем сахара в крови неожиданно большого объема глюкозы.
Небольшое число детей нуждается во введении какого-либо препарата в виде
быстрой болюсной инфузии (кроме случаев острого коллапса).
8. Препараты, которые необходимо вводить в течение 30 мин и
более, вводятся отдельным шприцевым насосом через инфузионную систему, подключенную к
существующей внутривенной линии. Шприц никогда не должен содержать более чем 2
дозы препарата. При проведении такой дополнительной инфузии скорость основной
инфузии не должна изменяться.
9. Избегайте случайного введения маленьким новорожденным детям избыточных
количеств натрия. Применение для промывания катетера растворов
Геплок, Гепсал (прим. – растворы гепарина) или 0,9% раствора натрия хлорида
иногда достаточно для того, чтобы удвоить суточное поступление натрия
маленькому новорожденному ребенку.
10. Назначение потенциально токсичных или летальных препаратов
(таких как хлорамфеникол или дигоксин) требует специальной осторожности.
Существует только относительно небольшое количество ситуаций, в которых
показано применение таких потенциально опасных препаратов.
Кроме того, в том же руководстве указаны, на наш взгляд, необычайно
ценные рекомендации для практической работы, которые можно охарактеризовать
«если что-то пошло не так»:
1. Взяли ли Вы тот препарат? Проверьте название и содержание
препарата на ампуле (флаконе) и коробке.
2. Не истек ли срок годности препарата? Проверьте маркировку
препарата.
3. Правильно ли препарат разведен? Прочтите рекомендации в
руководстве.
4. Тому ли пациенту Вы вводите препарат? Проверьте фамилию
пациента.
5. Правильную ли дозу препарата Вы вводите? Два человека
независимо друг от друга должны соотнести шаги 1-4 с формой назначения препарата.
6. Подсоединили ли Вы правильный шприц? Работайте в один момент
времени только с одним пациентом.
7. Проходима ли внутривенная линия? Правильную ли линию Вы
выбрали?
8. Необходимо ли введение разделяющего и промывающего раствора?
Два человека должны проверить содержимое шприца для промывания катетера.
9. Избавились ли Вы от всех острых частей (например, от
кончиков стеклянных ампул)?
10. Правильно ли Вы записали свои действия?
При подозрении на неправильную работу шприцевого насоса или
регулятора капельной инфузии выключите оборудование и замените его без изменения
установок скорости инфузии.
В заключение данной главы хотелось бы отобразить два вопроса. Один
касающийся данных так называемой «доказательной медицины» (подробно результаты
этих исследований представлены в приложении ). Второй – терапия гемодинамических
расстройств, встречающихся в неонатальной практике, наиболее часто.
Первый вопрос. Как правило, результаты исследований, рассмотренные
группой независимых экспертов и отвечающие всем «канонам доказательной
медицины», размещены в Кохреновской библиотеке, находящейся в сети Интернет. Но
учитывая, что не все врачи нашей страны имеют доступ, а также время находиться в
Интернете, а часто и некоторые проблемы с английским языком, кратко приводим
результаты исследований по обсуждаемым выше вопросам. При этом мы хотели бы
обратить внимание читателей на два обстоятельства. Во-первых, поскольку обзоры,
размещенные в Кохреновской библиотеке, достаточно обстоятельны и анализируют,
по мнению независимых экспертов, результаты всех доказательных
работ, опубликованных к настоящему времени, то экономя время читателей, мы
приведем только заключения экспертов. Вовторых, мы приведем данные, касающиеся
только глубоконедоношенных детей, руководствуясь следующими обстоятельствами:
терапия именно этой категории детей наименее изучена, эти дети представляют
наибольшую проблему в неонатологии, и последнее – по нашему глубокому убеждению,
врач не может и не должен пассивно читать – должен сам заниматься литературным
поиском, анализировать и критически подходить к прочитанному. Поэтому мы
оставляем возможность своим коллегам, которые не обращались к данной библиотеке,
открыть интересный, противоречивый и не совсем приемлемый для нас «мир
доказательной медицины».
Итак, мы рассмотрим дополнительный (больше физиологической
потребности) объем жидкости, назначаемый, как правило, для коррекции
действительной, а чаще всего предполагаемой гиповолемии, инотропную поддержку и
введение гидрокортизона.
Объем жидкости
Заключение экспертов. Нет никаких данных, позволяющих
рекомендовать ранее рутинное применение дополнительного объема жидкости у
недоношенных детей, за исключением случаев доказанной сердечно-сосудистой
недостаточности. Нет достаточных данных, позволяющих утверждать, что младенцы с
сердечно-сосудистой недостаточностью нуждаются в дополнительных объемах
жидкости. Нет достаточных данных, позволяющих рекомендовать тип раствора для
недоношенных детей, а также показаний для раннего применения эритроцитной массы.
Полный метаанализ не нашел исследований, за исключением одного, позволяющих
судить о том, что белковые препараты более эффективны, чем кристаллоиды, для
лечения гипотензии. Нет ясности в вопросе о терапии недоношенных детей с
сердечно-сосудистой недостаточностью: дополнительный объем жидкости должен
применяться первично или как дополнение к инотропной поддержке? Будущие
клинические исследования должны быть сосредоточены на способах определения
гиповолемии, функциональном состоянии сердца и органом кровотоке у недоношенных.
Необходимо ответить в будущих исследованиях о преимуществах коллоидов или
кристаллоидов у детей с сердечно-сосудистой недостаточностью.
Интропная поддержка
Адреналин
Заключение экспертов. Имеется одно небольшое рандомизированное
исследование, включившее всего 20 детей и показавшее, что адреналин, как и
допамин увеличивает частоту сердечных сокращений и среднее артериальное
давление, но ни один, ни второй препарат существенно не влияют на сократимость
миокарда. Нет никаких исследований, в которых бы анализировались такие важные
клинические результаты, как летальность или отдаленные психоневрологические
результаты. Нет исследований, зарегистрировавших изменения органного кровотока.
Нет данных, позволяющих дать клинические рекомендации по применению адреналина у
глубоконедоношенных детей.
Допамин и добутамин
Заключение экспертов. Результаты исследований предполагают, что
допамин более эффективен, чем добутамин в ранней коррекции артериальной
гипотензии у недоношенных детей. Нет достоверных различий по развитию тахикардии
у детей при лечении допамином или добутамином. Эффект допамина по сравнению с
добутамином на показатели отдаленного нервнопсихического развития остается
неизвестным. Нет убедительных данных, что коррекция системной гипотензии
эффективно увеличивает перфузию головного мозга и приводит к снижению частоты
поражений ЦНС. Нет согласия относительно определения гипотензии и пороговых
значений АД, ниже которых поражение ЦНС у глубоконедоношенных становится
неизбежной (в настоящее время в исследованиях приняты следующие
пороговые значения: сред. АД ≤ 30 мм рт.ст. или сист. АД ≤ 40 мм. рт.ст.
Является сомнительным ценность данных пороговых значений и возникает вопрос,
полезна ли терапия, направленная на лечение гипотензии, определенной такими
способами. Однако инвазивные методы лечения гипотензии чрезвычайно
распространены. Необходимо учитывать, что терапия допамином при увеличении АД
может приводить к снижению сократительной способности миокарда левого желудочка
у некоторых детей. Неизвестно предельно допустимое время терапии как допамином,
так и добутамином у глубоконедоношенных детей. Таким образом, допамин более
эффективен, чем добутамин в раннем лечении системной гипотензии у недоношенных.
Если предполагаемое время, за которое будет осуществлена стабилизация АД,
является коротким, то допамин является более предпочтительным препаратом, чем
добутамин. В то же время имеются данные, что добутамин в большей степени
улучшает мозговой кровоток, чем допамин. Однако в отсутствие данных,
подтверждающих, что, с одной стороны, терапия системной гипотензии является
полезной, а с другой, что имеется безопасность и эффективность длительного
применения допамина по сравнению с добутамином, никакие устойчивые клинические
рекомендации по выбору лекарственного средства для коррекции артериальной
гипотензии не могут быть сделаны. В связи с этим перед будущими исследователями
должен быть поставлен ряд вопросов:
1. Есть ли взаимосвязь между артериальной гипотензией, низким
мозговым кровотоком и повреждением ЦНС? Какой патофизиологический механизм является
основным?
2. Какое значение имеют другие факторы (например, открытый
артериальный проток, высокое давление в дыхательных путях или артериальное напряжение
СО2) и их влияние на вышеперечисленные механизмы.
3. Есть ли пороговые значения мозгового кровотока, давления в
сосудах головного мозга, системного артериального давления и функциональные показатели
сердца, позволяющие надежно идентифицировать детей, у которых впоследствии
могут развиться значительные неврологические нарушения.
4. Если системная гипотензия будет идентифицирована как
независимый фактор, способствующий повреждению ЦНС, то необходимо ответить связана ли
она со слабой сократимостью миокарда и особенностями функций сердца или с
низким сосудистым сопротивлением?
5. Какие медикаментозные средства и какие их дозы являются
эффективными в коррекции артериальной гипотензии и/или мозгового кровотока?
Кортикостероиды
Заключение экспертов. Есть недостаточное количество
исследований, позволяющих использовать гидрокортизон, как «первичный» препарат
для лечения гипотензии. Другие кортикостероиды не были изучены в
рандомизированных исследованиях. Имеется недостаточное количество данных,
полученных в ходе рандомизированных исследований относительно безопасности
стероидов, используемых для лечения гипотензии.
Единственная доза дексаметазона (0,25 мг/кг) может быть эффективна
на фоне инфузии адреналина при лечении рефрактерной гипотензии у недоношенных
детей. Учитывая недостаток данных относительно долговременного эффекта,
дексаметазон нельзя рекомендовать для рутинного использования для лечения
глубоконедоношенных детей с артериальной гипотензией.
Сформулированы следующие вопросы для дальнейших исследований:
1. Какие патофизиологические взаимоотношения между артериальной
гипотензией у недоношенных, мозговым кровотоком, повреждением ЦНС и
отдаленным психоневрологическим развитием. Какой основной патофизиологический
механизм повреждения? Какие еще факторы влияют на эти взаимоотношения?
2. Какие взаимоотношения между адренокортикальной функцией,
уровнями кортизола и развитием артериальной гипотензией? Есть ли группы
недоношенных, которые могут ответить на раннюю стероидную терапию?
3. Есть ли пороговые величины артериального давления, при
которых гемодинамическая поддержка, в том числе и стероидная, является обязательной?
4. Какие стероиды и их дозы являются наиболее эффективными для
коррекции артериальной гипотензии? Какие из них являются предпочтительными при
других состояниях, например, при сепсисе и т.д.?
5. Каковы эффекты коротких и длительных курсов стероидной
терапии?
6. Действительно ли профилактическое применение стероидов (антенатально)
более безопасно и эффективно, чем лечение установленной или
рефрактерной гипотензии? Конечно, на многие из этих вопросов можно найти
ответы в русскоязычной литературе, но в том-то и вопрос, что, по мнению большинства западных
экспертов, большинство исследований, проведенных в нашей стране, не отвечают
общепринятым критериям «доказательности». Конечно, очень обидно, но факт
остается фактом. Наверное, надо что-то менять в наших научных исследованиях…
Коррекция гемодинамических расстройств при различных
патологических состояниях
Для понимания основных проблем, с которыми может столкнуться
детский анестезиолог или неонатолог при стабилизации гемодинамики у критически
больных новорожденных, требующих межбольничного перевода в стационар более
высокого уровня, или для проведения специализированного лечения, необходимо
разделить понятия сердечной и сосудистой недостаточности. Это нужно, во-первых,
потому, что смешивание всех расстройств гемодинамики в существовавший долгое
время термин «сердечно-сосудистая недостаточность» затрудняет понимание
клиницистом ведущих механизмов циркуляторной несостоятельности в каждом
конкретном случае, а во-вторых, это объединение справедливо уже в терминальной
фазе критических состояний, фактически соответствующих началу танатогенеза.
С достаточной долей условности и прежде всего для проведения
дифференциальной диагностики можно выделить 4 основных вида кардиоваскулярных
расстройств у новорожденных (Crisp S., Rainbow J., 2007):
1) шум в сердце;
2) центральный цианоз;
3) острая сердечная недостаточность;
4) шок.
Еще раз оговоримся, что это не классификация, а отдельные
состояния, требующие различной гемодинамической поддержки.
Шум в сердце
Наиболее часто шум в сердце в первые сутки после рождения, особенно
у недоношенных новорожденных, характерен для функционирующего артериального
протока. Для него характерны:
– постоянный систолодиастолический шум (возможно,
систолодиастолическое дрожание под левой ключицей), проводящийся как
перикардиально, так и на спину;
– альтернирующий пульс.
При сочетании с РДС необходима госпитализация в специализированное
отделение интенсивной терапии и проведение обследования:
1) пульсоксиметрия. При цианозе – исключить персистирующую
легочную гипертензию новорожденных (ПЛГН);
2) рентгенограмма органов грудной полости для исключения
легочной патологии;
3) ЭхоКГ + допплерКГ (парастернальный доступ по короткой оси
левого желудочка);
4) НСГ + допплер средней и/или передней мозговой артерии (выраженная
разница скорости систолического и диастолического компонента, реверсирующий
диастолический поток);
5) до исключения диагноза – ограничить объемную скорость
инфузии;
6) при наличии гемодинамически значимого ОАП – индометацин:
– первая доза 0,2 мг/кг, вторая и третья – по 0,1 мг/кг
через 12-24 ч.
NB. Развитие позднего неонатального сепсиса, особенно
гиперэргического варианта, часто сочетается с реперфузией ductus arteriosus!
Центральный цианоз
Центральный цианоз проявляется у 3-4% всех новорожденных и, как
правило, является признаком тяжелого заболевания (см. таблицу 127). Основные
причины цианоза следующие:
– первичные легочные заболевания;
– врожденные пороки сердца;
– персистирующая легочная гипертензия новорожденных (PPHN);
– сепсис;
– анемия;
– асфиксия;
– метгемоглобинемия.
Таблица 127. Дифференциальная диагностика причин центрального
цианоза у новорожденных
Общие рекомендации у детей с центральным цианозом
1. Исследовать газы крови при дыхании, по возможности атмосферным воздухом,
предпочтителен забор крови из правой лучевой артерии (предуктально).
2. Измерить АД на всех 4 конечностях. Разница в систолическом
АД между верхними и нижними конечностями >10 мм рт.ст. у новорожденного с цианозом
свидетельствует в пользу коарктации аорты.
3. Коррекция метаболического ацидоза и системной гипоперфузии
объемной нагрузкой 10-20 мл/кг и введением бикарбоната натрия.
4. Гипероксический тест:
• 100% О под палатку в течение >10 мин;
• мониторинг SaO2;
• повторить газы артериальной крови:
– РаО2 > 100 мм рт.ст. или повышение SaO2 > 15% – легочная
патология;
– РаО2 < 70 мм рт.ст., Δ РаО2 < 30 мм рт.ст. или SaO2 без
изменений – ВПС / ПЛГ;
• ограничения гипероксического теста:
– не настолько достоверен, как ЭхоКГ и не настолько важен,
как коррекция ацидоза и вентиляция;
– трактовка ограничена, если измеряется только SaO2 и не
исследуется предуктальное РаО2.
1. Измерить разницу SaO2 на правой и левой руках (ductus
arteriosus?).
2. Рентгенограмма органов грудной полости и ЭКГ.
3. Две периферические венозные канюли и/или катетеризация
пупочной вены.
4. При наличии факторов риска или данных за текущий инфекционный процесс,
антибиотики широкого спектра – парентерально.
5. При подозрении на дуктусзависимый ВПС – введение
простагландина E1.
6. Введение инотропов для улучшения контрактильности миокарда /
поддержки АД.
7. Госпитализация новорожденного в кардиохирургический центр.
Большая часть цианотических врожденных пороков сердца должна быть
диагностирована антенатально. Цианоз может развиться сразу после рождения или
спустя некоторое время.
NB. Поскольку значительная часть пороков синего типа являются
дуктусзависимыми, проведение гипероксического теста может усугубить тяжесть
состояния!
Манифестация цианоза в первые 24-48 часов после рождения:
• транспозиция магистральных сосудов;
• стеноз или атрезия легочной артерии (± ДМЖП);
• атрезия трикуспидального клапана;
• аномалия Эбштейна;
• обструктивный тотальный аномальный дренаж легочных вен.
Манифестация цианоза позднее 48 часов после рождения:
• тетрада Фалло;
• AV канал (типичен для болезни Дауна);
• общий артериальный ствол;
• тотальный аномальный дренаж легочных вен.
При невозможности или трудностях топической
диагностики врожденного порока сердца необходимо (особенно при раннем
возникновении цианоза) провести тест с простагландином Е1. Если при введении
алпростадила (вазапростан, алпростан) в дозе 0,01-0,05 мкг/кг/мин степень
цианоза уменьшается (SaO 80-85% и выше), порок является дуктусзависимым, и
возможно оперативное лечение в ургентно-отсроченном порядке. Если при введении
алпростадила степень цианоза не уменьшается и исключена легочная патология и
персистирующая легочная гипертензия, ребенок должен быть прооперирован в течение
ближайших часов в связи с высоким риском смерти.
NB. При наличии дуктусзависимого ВПС ребенок должен
вентилироваться смесью с FiO2 не более 0,25-0,28 из-за риска закрытия протока и разобщения
большого и малого кругов кровообращения!
Дуктусзависимый легочный кровоток (критический стеноз легочной
артерии, транспозиция магистральных сосудов) характеризуется следующими
клиническими особенностями:
– цианоз;
– тахипноэ без респираторного дистресса;
– при рождении возможна адекватная тканевая перфузия.
Дуктусзависимый системный кровоток (коарктация аорты, синдром
гипоплазии левых отделов сердца, критический аортальный стеноз) характеризуется
следующими клиническими особенностями:
– сердечная недостаточность с системной гипоолигоанурией;
– снижение / отсутствие пульса на периферических сосудах;
– выраженный метаболический ацидоз;
– цианоз может не развиваться вплоть до поздних стадий
заболевания. Персистирующая легочная гипертензия новорожденных (ПЛГН) является
одним из жизнеугрожающих состояний, характеризующихся центральным цианозом у
новорожденных. Гемодинамическая гипоксия и право-левое шунтирование крови
ухудшают функцию желудочков сердца и могут приводить к развитию кардиогенного
шока.
ПЛГН может быть первичной (более редкий вариант, на рентгенограмме
– нормальная картина легких) или вторичной, развивающейся чаще всего на фоне
острой легочной патологии.
• Респираторные причины: синдром аспирации мекония, ОРДС,
врожденная диафраг-
мальная грыжа, врожденная пневмония, врожденная кистозная
аденоматоидная мальформация.
• Нереспираторные: асфиксия в родах, анемия, полицитемия,
сепсис.
Клинико-эхографические признаки ПЛГН:
– степень цианоза не коррелирует с тяжестью поражения легочной
ткани;
– при ультразвуковом исследовании сердца – высокий градиент
давления при измерении скорости трикуспидальной регургитации, расширение
ствола ЛА, уплощение клапана ЛА.
Терапия ПЛГН
|
8. Вспомогательная вентиляция легких 100% О2 |
с контролем давления. Цель: поддержа- |
|
ние РаО2 |
80-100 мм рт. ст. и РаСО2 |
35-40 мм рт. ст. |
|
9. Соблюдение теплового режима (см. главу 10) – гипотермия
усиливает легочную вазо-
констрикцию.
10. Предупреждение бактериальных осложнений, в том числе и
сепсиса – бактериологическое обследование, в/в антибиотики широкого спектра.
11. Поддержание АД – введение добутамина 10-20 мкг/кг/мин в
сочетании с допамином
5-10 мкг/кг/мин.
12. Поддержание рН на уровне 7,5-7,6 – введение натрия
бикарбоната 0,25-1,0 ммоль/кг/час.
13. Ограничение объемной скорости инфузии до 0,5-1 мл/кг/час.
14. Алпростадил 0,1 мкг/кг/мин.
15. Введение фуросемида 1-2 мг/кг в/в. |
|
16. Инфузия MgSO4 |
8% 25-50 мг/кг/час. |
|
17. iNO 5-20 ppm.
18. Использование внутривенных нитратов: нитроглицерина и др.
19. При отсутствии терапевтического эффекта –
экстракарпоральная мембранная оксигенация (ECMO). |
Острая сердечная недостаточность (ОСН)
Острая сердечная недостаточность (ОСН) – это клинический
синдром, проявляющийся уменьшением сердечного выброса, гипоперфузией тканей,
повышением давления в легочных капиллярах и застойными явлениями в тканях. К
развитию ОСН могут приводить внутриили внесердечные механизмы, которые могут
быть проходящими и обратимыми с разрешением клинического синдрома, или могут
вызывать необратимое поражение с развитием хронической сердечной недостаточности
(ХСН). Конечным общим результатом при синдроме ОСН является критическая
неспособность миокарда поддерживать сердечный выброс на уровне, достаточном для
соответствия потребностям периферического кровообращения (Рекомендации по
диагностике и терапии острой сердечной недостаточности Европейского общества
кардиологов, 2005).
Общепринятой классификации сердечной недостаточности в педиатрии
нет. Существующие классификации не лишены субъективизма и мало приемлемы в
раннем детском возрасте (Сенаторова А.В., 2002).
По Цыбулькину Э.К. (1994) ОСН клинически проявляется:
– синдромом малого сердечного выброса (СМСВ) в виде артериальной
гипотонии и признаков централизации кровообращения;
– застойной сердечной недостаточностью (ЗСН) с перегрузкой малого
или большого кругов кровообращения. Признаки застоя в большом круге:
периферические отеки, увеличение печени, контурирование шейных вен, асцит,
гидроторакс. Признаки застоя в малом круге: одышка, влажные хрипы в нижних
отделах легких, клиника отека легких, неэффективность ингаляции больших
концентраций кислорода.
1. Наиболее частыми причинами СМСВ у новорожденных детей
являются:
– транзиторная дисфункция миокарда левого желудочка (ТДМЛЖ),
развивающаяся вследствие острой гипоксии и/или ацидоза;
– аритмогенный шок – брадиаритмии (синусовые или вследствие
AV-блокады, фибрилляция желудочков, групповые желудочковые экстрасистолы) или
тахиаритмии (чрезмерные тахикардии – гипермотильный токсикоз Кишша или острая
коронарная недостаточность у новорожденных и детей раннего возраста,
наджелудочковая пароксизмальная тахикардия, мерцание и трепетание предсердий и
др.);
– гипердинамический вариант острой сердечной недостаточности при
сепсисе, чаще при гиперэргическом варианте;
– острая тампонада сердца (гидроперикард, гемоперикард,
пневмоперикард);
– врожденные пороки сердца с лево-правым шунтированием крови.
2. Крайним вариантом манифестации СМСВ является кардиогенный шок.
3. Наиболее частыми причинами ЗСН являются:
– острые бронхолегочные поражения (ОРДС, пневмонии, ателектазы,
гидро-и пневмоторакс, пр.), при которых главными механизмами формирования
сердечной недостаточности являются собственно гипоксия и легочная гипертензия
вследствие внутрилегочного шунтирования крови;
– врожденные пороки сердца с право-левым шунтированием крови;
– иатрогенная гиперволемия (перегрузка объемом).
4. Крайним вариантом манифестации ЗСН является кардиогенный отек
легких.
Низкий системный кровоток характерен в первые 24 часа после
рождения для очень недоношенных детей (и для более зрелых детей с тяжелыми
респираторными проблемами), и это состояние не всегда сочетается с низким
кровяным давлением (см. выше). Как мы уже указывали, причины низкого системного
кровотока сложны, но могут быть связаны с нарушением адаптации к высокому
внеутробному системному (и иногда легочному) сосудистому сопротивлению. После
первого дня жизни у гипотензивных детей более вероятно наличие нормального или
высокого системного кровотока, отражающего вазодилятацию. По нашим наблюдениям,
инотропы, снижающие постнагрузку, например добутамин, вероятно, более показаны в
переходный период, в то время как инотропы с более выраженным вазоконстрикторным
действием, такие как допамин, могут быть полезны позже.
Оценка состояния гемодинамики у конкретного ребенка требует как
определения АД, так и эхокардиографического измерения системного кровотока. По
нашему мнению, акценты исследования в этой области необходимо сместить с простой
констатации изменений физиологических переменных на изучение факторов,
улучшающих клинические исходы.
Циркуляторная поддержка направлена на обеспечение доставки
кислорода органам и тканям организма. Это, в свою очередь, зависит от
кислородсвязывающей способности крови, содержания кислорода в крови и объема
крови, который доставляется тканям. Содержание кислорода легко измерить. Но, как
мы уже указывали, измерение кровотока значительно сложнее, поэтому в клинических
условиях часто используется АД в качестве показателя, косвенно отражающего
кровоток. В течение многих лет неонатальная циркуляторная поддержка основывалась
на допущении пропорциональности между АД и системным кровотоком, особенно в
отношении церебральной циркуляции. Однако давление представляет собой
произведение потока и резистентности, и оно может быть низким, если поток либо
резистентность или то и другое являются низкими. Обеспечение соответствующего
лечения требует понимания происходящего и осознания того, что такое понимание
трудно достичь, основываясь только на АД.
Гемодинамическая модель переходной циркуляции у недоношенных.
Внутриутробная циркуляция определяется плацентой с низким сопротивлением,
вследствие чего миокард подвергается низкой постнагрузке. После преждевременного
рождения незрелый миокард должен быстро адаптироваться к высокому сопротивлению
легочной и системной циркуляции. Другие влияния на переход от внутриутробной к постнатальной циркуляции
включают повышенное внутригрудное давление, вследствии использования постоянного
положительного давления в дыхательных путях (СРАР) и механической вентиляции.
Это может снижать венозный возврат к сердцу и нарушать наполнение сердечных
камер из-за прямого влияния внутригрудного давления на предсердия.
Системно-легочные коммуникации определяются, главным образом,
артериальным протоком, который зачастую является большим и шунтирует кровь из
системной в легочную циркуляцию в первые часы после рождения. Как результат этих
изменений гемодинамики часто развивается критически низкий системный кровоток, и
если он не распознан, существует значительный потенциал для поражения уязвимых
органов, включая головной мозг. У более зрелых младенцев сердечно-сосудистая
система, вероятно, справляется с этими изменениями в течение короткого периода
времени, но обычно в течение первых 12 часов постнатальной жизни это является
проблемой.
Развитие повреждения зависит от зрелости ребенка, степени и
продолжительности гипоперфузии и клинического течения заболевания к моменту
улучшения перфузии. По неизвестным причинам сердечно-сосудистая система начинает
адаптироваться у почти всех новорожденных после 24 часов, и кровоток постепенно
улучшается, часто спонтанно.
Функционирующий артериальный проток (см. выше). ОАП на
протяжении первой недели жизни сопровождается как более низким систолическим и
диастолическим АД, так и более низким средним АД. Это является следствием того,
что дуктус обуславливает более низкое сопротивление в системной циркуляции из-за
сброса крови в легочную циркуляцию с низким АД на протяжении сердечного цикла.
Наиболее значительные открытые артериальные протоки являются клинически немыми
на протяжении первых трех постнатальных дней и о возможности наличия такого
протока необходимо помнить у детей с низким АД.
Доношенный ребенок с асфиксией, персистирующей легочной
гипертензией новорожденных (ПЛГН), тяжелым респираторным дистрессом (см.
выше). Это гетерогенная группа детей, имеющих высокий риск развития низкого
системного кровотока в первые 24 часа, и у которых, как у недоношенных детей,
частота низкого системного кровотока снижается с возрастом. У детей с
перенесенной асфиксией, гипоксически-ишемическое повреждение миокарда (ТДМЛЖ)
имеет важное значение в этнопатогенезе многих состояний. Одним из факторов,
часто не принимаемым во внимание, является потенциальная вероятность высокого
сопротивления в легочной циркуляции и возможность ухудшения системной
циркуляции.
Левый желудочек может перекачивать по организму только тот объем
крови, который он получает из легочного венозного возврата. Если легочное
сосудистое сопротивление достаточно высоко, чтобы ограничить легочной кровоток,
а артериальный проток и овальное окно закрыты или почти закрыты (как часто
бывает у этих более зрелых детей), то системный кровоток будет аналогичным
образом снижен. Установлено, что миокардиальная сократимость у этих детей
плохая, но низкая преднагрузка левого желудочка будет также вносить свой вклад в
развитие синдрома малого сердечного выброса. Таким образом, это может являться
вторичным, а не первичным феноменом. Возможно существенное повышение сердечного
выброса у детей, получающих оксид азота.
Рекомендации в отношении гемодинамической поддержки у
новорожденных с острой сердечной недостаточностью
1. Обеспечить адекватное пульсовое давление за счет
волемической нагрузки кристаллоидами 10-20 мл/кг.
2. Коррекция ацидоза. Цель: рН ≥ 7,25-7,28 (при ПЛГН ≥
7,5-7,6).
3. Коррекция уровня кальция в сыворотке крови. Цель: [Са2+] ≥
1,2 ммоль/л.
4. Коррекция острой анемии. Цель: Ht ≥ 0,35-0,40.
5. Исключить:
– некардиогенные виды шока;
– пневмоторакс;
– тампонаду сердца;
– «злокачественный» артериальный проток;
– продолжающееся кровотечение.
6. Диагностика неонатальной суправентрикулярной тахикардии.
7. Дифференциальная диагностика врожденных пороков сердца.
Что касается инотропной поддержки, то мы установили (Сурков Д.Н.,
Снисарь В.И.,
2005), что применение добутамина в дозах 5-7,5 мкг/кг/мин более
оправдано, чем использование дофамина в аналогичных дозах из-за его влияние на
ЧСС. Введение дофамина в низких дозах (до 3 мкг/кг/мин сопоставимо с
использованием добутамина в увеличении сердечного индекса, не приводит к
повышению ЧСС и является методом выбора из-за соотношения стоимость/эффект и
сопутствующего увеличения почечного и спланхнического кровотока.
Таблица 128. Основные направления терапии сердечной недостаточности
у новорожденных
|
Группы новорожденных |
Проблема
|
Кардиоваскулярные проявления
|
Предлагаемые направления терапии
|
|
Недоношенные с низкой
и экстремально низкой массой тела при рождении |
низкий системный кровоток,
первый день после рождения |
нормальное или низкое АД;
низкий кровоток
в выносящем тракте правого/левого желудочка; большой
артериальный проток;
высокое системное
и/или легочное сосудистое сопротивление;
плохая сократимость миокарда |
физраствор 10-20 мл/кг;
препарат выбора: добутамин 10-20 мкг/кг/мин титруемый для
поддержания:
кровотока в выносящем тракте правого/
левого желудочка > 120 мл/кг/мин;
СИ ≥ 2,2-2,5 л/м2/мин препарат второго ряда: допамин 5-7
мкг/кг/мин, титруемый по АД;
препарат третьего ряда: адреналин
0,05-0,1 мкг/кг/мин, титруемый по АД |
|
Недоношенные новорожденные |
низкое АД, особенно после первого дня |
нормальный или высокий кровоток в выносящем тракте
правого/левого желудочка;
низкое системное сосудистое сопротивление |
препарат выбора: допамин 5-7 мкг/кг/мин, титруемый по АД |
|
Новорожденные с наличием асфиксии |
низкий системный кровоток |
нормальное или низкое АД; плохая сократимость миокарда |
физраствор 10-20 мл/кг;
препарат выбора:
добутамин 10-20 мкг/кг/мин, тируемый для поддержания:
кровотока в выносящем тракте правого/
левого желудочка > 120 мл/кг/мин;
СИ ≥2,5 л/м2/мин;
препарат второго ряда: допамин
5-10 мкг/кг/мин, титруемый по АД;
препарат третьего ряда: адреналин
0,05-0,1 мкг/кг/мин, титруемый по АД |
|
Сепсис новорожденных |
«сепсис
с гипердинамией», чаще при гиперэргическом варианте |
нормальное или низкое АД; высокий системный кровоток в
выносящем тракте правого/левого желудочка;
высокое системное
и/или легочное сосудистое сопротивление |
физраствор 10-20 мл/кг, может быть необходимость в больших
объемах; препарат выбора:
добутамин 10-20 мкг/кг/мин, тируемый для поддержания:
кровотока в выносящем тракте правого/
левого желудочка > 120 мл/кг/мин;
СИ ≥ 2,5 л/м2/мин;
препарат второго ряда (гипотензия):
допамин 5-10 мкг/кг/мин или адреналин
0,05-0,1 мкг/кг/мин титруемые по АД |
Окончание таблицы 128
|
Группы новорожденных |
Проблема
|
Кардиоваскулярные проявления
|
Предлагаемые направления терапии
|
|
Младенцы
с респираторным дистрессом |
легочная гипертензия |
нормальное или низкое АД; нормальный или низкий кровоток в
выносящем тракте правого/левого желудочка;
высокое легочное сосудистое сопротивление |
препарат выбора:
добутамин 10-20 мкг/кг/мин, титруемый для поддержания:
кровотока в выносящем тракте правого/
левого желудочка > 120 мл/кг/мин;
СИ ≥ 2,5 л/м2/мин;
препарат второго ряда (низкие кровотоки): допамин 5-10
мкг/кг/мин или адреналин 0,05-0,1 мкг/кг/мин |
Шок у новорожденных
Острая сосудистая недостаточность представлена синдромом шока.
Шок – это острое нарушение периферического кровообращения, приводящее к
недостаточности тканевой перфузии, нарушению выведения метаболитов и необратимым
клеточным повреждениям, синдром, проявляющийся в результате несоответствия
доставки кислорода потребностям тканей.
По типу нарушений гемодинамики выделяют следующие варианты шока
(рисунок 67):
– гиповолемический (постгеморрагический, травматический,
дегидратация при НЭК, кишечной непроходимости, др.);
– распределительный (дистрибутивный – септический);
– кардиогенный;
– анафилактический;
– смешанные.
Краеугольными камнями неотложной помощи при шоке являются
предупреждение его возможного развития, ранняя диагностика и агрессивная
интенсивная терапия. Как только развиваются вторичные осложнения (ОРДС, ОПН и
т.д.), реверсировать шок становится очень трудно, и смертность в зависимости от
вида шока будет достигать 30-60%.
Ключевыми направлениями являются поддержание адекватной тканевой
перфузии и оксигенация.
Необходимо беспечить проходимость дыхательных путей, вентиляцию,
поддержку кровообращения. Новорожденные с клиническими проявлениями шока должны
быть интубированы и переведены на вспомогательную вентиляцию, невзирая на
наличие или отсутствие у них признаков дыхательной недостаточности и
непосредственных показаний к проведению респираторной поддержки. Интубация
должна предотвращать развитие декомпенсации у детей в критическом состоянии.
Алгоритм терапии при аритиогенном шоке представлен на схеме 5.
Параллельно необходимо направить все усилия на поддержание
гемодинамики:
• Остановить любое кровотечение.
• Мониторировать насыщение гемоглобина кислородом (сатурацию).
При необходимости – оксигенотерапия.
• Обеспечить адекватный венозный доступ.
• Периферическая венозная канюля? – Не тратить время на
периферический венозный доступ, если он затруднен!
• Если есть трудности с периферическим доступом,
катетеризировать пупочную вену
(5 Fr у недоношенных, 5-8 Fr у доношенных).
• При невозможности катетеризации пупочной вены –
внутрикостный доступ (см. рисунок 68).
Установить причины развития шока, включая иатрогении. Этиотропное
лечение. Подтвердить или исключить сепсис. Включение комбинаций антибиотиков
широкого спектра.
Подтвердить или исключить врожденный герпес и необходимость
использования ацикловира.
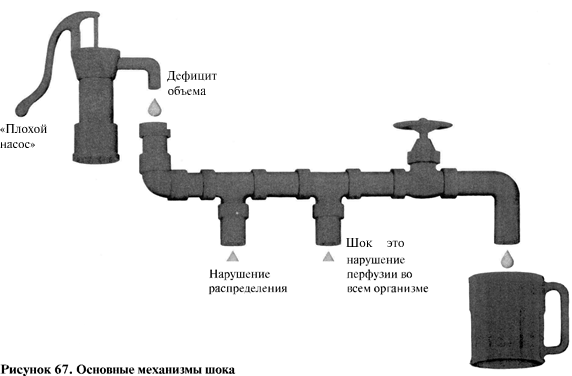
Рисунок 68. Типичные точки для внутрикостного доступа
Исключить:
– пневмоторакс;
– тампонаду сердца;
– продолжающееся кровотечение.
Предпочтительным является проксимальный доступ. Точка вкола
располагается на 1-2 см ниже бугристости большеберцовой кости по центру
переднемедиальной поверхности. Игла направляется каудально от верхнего
тибиального в направлении костно-мозгового канала. Альтернативным доступом
является дистальный тибиальный, который может использоваться у детей любого
возраста. Дистальный бедренный и стернальный доступы у детей в настоящее время
не используются.
После введения внутрикостной иглы (возможно использование иглы Дюфо),
обязательно произвести аспирацию 1-2 мл до появления в шприце крови, что будет
свидетельствовать о разрушении нескольких костных балок вокруг среза иглы, или
ввести с этой же целью под напором 5-10 мл физиологического раствора.
Обеспечить адекватное восполнение объема циркулирующей крови.
Ввести 10-20 мл/кг 0,9% NaCl. Повторить при отсутствии хорошего
ответа.
При наличии достоверных признаков выраженной кровопотери или
дефицита жидкости использовать б льшие объемы.
Тяжелый сепсис может потребовать болюсного введения жидкости из
расчета 40-60 мл/кг для адекватного восполнения ОЦК.
Нет доказательств преимущества коллоидов над кристаллоидами на
начальном этапе объемной ресусцитации.
При кровопотере показана ранняя гемотрансфузия. При дефиците
времени можно использовать эритроцитарную массу 0(І)Rh без проведения проб на совместимость донора и реципиента. В родах возможно переливание плацентарной крови с
использованием гепаринизированных шприцев и кровяных фильтров.
После стабилизации состояния решить вопрос о необходимости
переливания препаратов крови. Свежезамороженная плазма и тромбоцитарная масса переливаются
только при наличии продолжающегося кровотечения или выраженных нарушениях
коагуляции.
Продолжить коррекцию ацидоза.
Основная цель на этом этапе – стабилизация
гемодинамики, перфузии тканей и вентиляции. Если это достигнуто, и сохраняется
ацидоз, ввести бикарбонат натрия из расчета:
При недостаточном эффекте терапии:
– уточнить диагноз;
– провести трансиллюминацию грудной клетки (пневмоторакс) или
рентгенологическое исследование;
– удостовериться в проходимости дыхательных путей и
адекватности вентиляции;
– убедиться в адекватности объемной нагрузки. Эффект недостаточен
или отсутствует:
– инфузия адреналина 0,05-0,1 мкг/кг/мин;
– введение стероидов (гидрокортизон 3 мг/кг в/в каждые 6 часов)
для повышения чувствительности симпатических рецепторов к катехоламинам,
особенно у недоношенных с экстремально низкой массой тела;
– норадреналин в дозе 0,2-1,0 мкг/кг/мин вводится при
рефрактерном септическом шоке только в условиях ОИТН!
Отсутствие эффекта инотропной терапии может быть связано с
развитием резистентности к катехоламинам. Это общая проблема при лечении
тяжелого сепсиса, хронической гипоксии или сердечной недостаточности. Добутамин
и допамин не работают в этой ситуации. Возможно раннее назначение адреналина,
использование ингибиторов ФДЭ (милринон в нагрузочной дозе 25-75 мкг/кг за 10-20
мин затем 0,375-0,75 мкг/кг/мин).
Терапия вторичных осложнений шока
Респираторный дистресс.
Ранняя интубация трахеи и перевод на вентиляцию с контролем по
давлению.
Возможно присоединение отека легких, ТЛГН или пневмонии. Их лечение
состоит в подборе режимов вспомогательной вентиляции и описано в соответствующей
главе данного руководства.
Комбинация миокардиальной и циркуляторной
недостаточности с эндотелиальной дисфункцией практически всегда ухудшают
респираторный паттерн у новорожденных. В этой связи при проведении вентиляции,
как правило, возникает необходимость более высокого, чем обычно, РЕЕР (6-8 см Н
О). Однако следует быть аккуратным с подбором величины РЕЕР из-за возможного
негативного влияния на венозный возврат к левому желудочку.
Быстрая респираторная стабилизация новорожденных в критическом
состоянии чаще всего ассоциируется с допустимой вентиляционной агрессией, что
зачастую чревато риском возникновения осложнений. В этой связи крайне важно
пересматривать параметры вентиляции в сторону более «мягких» стратегий сразу же
после стабилизации состояния пациента. Респираторная поддержка должна быть
адекватной, но не избыточной! Чрезмерно низкие уровни РаСО (< 28-25 мм рт.ст.) ассоциируются с высоким риском поражения ЦНС,
особенно в сочетании с сепсисом.
Таблица 129. Цели вентиляционной поддержки при шоке новорожденных
|
рН |
7,25-7,35 |
|
РаСО2
|
40-55 мм рт.ст. |
|
РаО2
|
50-80 мм рт.ст. |
|
ВЕ |
> [-8,0] |
|
SaO2
|
90-95% |
Еще одна проблема, с которой обычно приходится сталкиваться при
ведении больных с шоком – поражение почек. Почечная недостаточность является
одним из значимых и угрожающих составляющих большинства шоков у новорожденных.
Как правило, она проявляется олигурией и связана с острым тубулярным или
кортикальным некрозом. Осложнения включают в себя гиперкалиемию и патологическую
задержку жидкости с гиперволемией.
Если диурез у младенца < 0,5 мл/кг/час в первые сутки и 1,0
мл/кг/час в последующие:
• объемная нагрузка 10 мл/кг;
• фуросемид 2 мг/кг в/в;
• низкие дозы допамина 2-5 мкг/кг/мин.
Глубоконедоношенные новорожденные с почечной недостаточностью
склонны к развитию гиперкалиемии, что может стать причиной остановки сердца.
Гиперкалиемия при острой почечной недостаточности чаще всего развивается в
течение первых 2-3 дней жизни. У новорожденных высокого риска необходимо
контролировать уровень К+ каждые 8 часов (см. главу 16).
В заключении данной главы приводим алгоритм неотложных мероприятий
у гемодинамически нестабильного новорожденного.
Схема 6. Неотложные мероприятия у гемодинамически нестабильного
новорожденного

