Данная информация предназначена для специалистов в области здравоохранения и фармацевтики. Пациенты не должны использовать эту информацию в качестве медицинских советов или рекомендаций.
4.2. Методы выявления и регистрации неблагоприятных побочных реакций
Современная статистика свидетельствует о том, что миллионы людей получают
тяжелые, подчас необратимые осложнения лекарственной терапии. Анализ,
проведенных в последние годы фармакоэпидемиологических исследований, убедительно
свидетельствует о том, что проблема безопасности лекарств становится не только
проблемой национальной безопасности отдельных стран, но перерастает в серьезную
глобальную проблему (Алиева Н.Г., 2001; Давыдов Ю. В., Файзуллина Е. В., 2012;
Patterson R., Grammer L. C., Greenberger P. A., 1997). Так, в
специально проведенных исследованиях было показано, что тяжелые, подчас
необратимые осложнения в результате лекарственной терапии развиваются у
миллионов людей. Количество летальных исходов, связанных с применением лекарств,
исчисляется сотнями тысяч. Затраты, связанные с побочными реакциями на
медикаменты, составляет в разных странах от 5,5% до 17% общего бюджета больниц (Allergy.,
1988; American Academy of Allergy, 1996–2001; WHO., 2012).
Неблагоприятные побочные реакции на лекарственные средства многообразны по
своим клиническим проявлениям, по механизмам и частоте их возникновения. Есть
немало вопросов, касающихся патогенеза развития НПР и роли различных факторов в
этих процессах, которые до сих пор остаются неясными, несмотря на совершенство
методов их выявления. Принципы анализа основных методов выявления и изучения НПР
заключаются в оценке их достоинств и недостатков (табл. 4.2), которые позволяют
выбрать метод или их сочетание для получения наиболее достоверных данных о
распространении и причинно-следственных связях НПР в условиях конкретной клиники
и или группе клиник. Полученные результаты позволят сформировать базу данных о
НПР и безопасности фармакотерапии.
Как известная талидомидовая трагедия явилась стимулом к организации служб
фармаконадзора во многих странах мира. Повторение ситуации через 10 лет на фоне
применения препарата практолол, послужила основанием для активизации разработок
новых методов выявления НПР. У сотен больных это ЛС явилось причиной развития
тяжёлого осложнения, известного под названием «глазослизисго-кожного синдрома».
Были зарегистрированы и летальные исходы в результате этой НПР, а также случаи
слепоты, поражений слуха, перитонита вследствие изъязвления слизистых оболочек
под влиянием препарата. Ранними проявлениями этого грозного осложнения были
незначительные изменения функций тех или иных органов в виде псориазоподобных
высыпаний, коньюктивитов, сухости слизистой глаз. Врачи не считали нужным
сообщать о них в соответствующие инстанции, полагая, что это обычные, с точки
зрения практики, самостоятельные нарушения. Именно история с практололом
продемонстрировала несовершенство метода спонтанных сообщений в плане выявления
НИР и определения частоты возникновения НПР.
Гражданское общество и практикующие врачи в своем большинстве до сих пор
считают, что разрешение соответствующего контрольно-разрешительного органа на
использование в медицинской практике нового лекарственного средства после
экспериментальных и клинических испытаний автоматически формирует гарантию
безопасности его применения. Однако многолетняя практика авторов публикации и
данные многочисленных исследований показали, что это ошибочное мнение. Следует
отметить, что с момента внедрения нового лекарственного средства в практику до
обнаружения у него способности вызывать НПР может проходить довольно много
времени, иногда несколько десятков лет.
Например, для того, чтобы установить факт того, что аминофеназон (амидопирин,
пирамидон), поражая костный мозг, угнетает кроветворение, потребовалось более 40
лет его применения в клинической практике. Амидопирин применяется в медицине с
1889 г., и только в 1933 г. появилось предположение о том, что он и другие
препараты, содержащие бензольное кольцо, могут быть причиной развития
агранулоцитоза. В связи с этим безрецептурная продажа амидопирина была запрещена
в Великобритании с 1936 г., в США — с 1938 г., а затем в 1970-80-х гг. это ЛС
было запрещен к применению более чем в 38 странах мира. На установление
причинно-следственной связи между приёмом ацетилсалициловой кислоты (аспирина) и
желудочными кровотечениями ушло почти 40 лет и ещё около 20 лет на то, чтобы
этот факт стал общепризнанным.
Таблица 4.2. Сводные данные о принципах, достоинствах и преимуществах методов выявления и изучения НПР
| |
Метод |
Принцип |
Возможности и достоинства |
Недостатки |
|
I.
|
Метод спонтанных сообщений |
Выявление подозреваемых НПР типов
А и В (преимущественно) на все препараты широкой медицинской практики.
Врачи добровольно или на основании законодательства информируют обо всех
подозреваемых НПР в фармаконадзор. |
Простота и дешевизна. Позволяет
осуществлять контроль безопасности ЛС в течение всего периода его пребывания
на рынке.
Позволяет выявлять редкие и новые НПР.
Охватывает большое число больных и ЛС.
Позволяет получить предварительные сведения о частоте НПР и степени
риска.
Охватывает больных стационаров и амбулаторной практики. |
Не позволяет выявлять весь спектр
побочных эффектов. Не сообщается обо всех выявляемых НПР.
Не позволяет определять истинную частоту возникновения НПР.
Неэффективен в выявлении отсроченных НПР.
Затруднена интерпретация полученных данных из-за неполных и неточных
сведений в сообщениях. |
|
II.
|
Интенсивный мониторинг в
стационаре |
Учет медицинских, демографических,
социальных данных о больных стационара (группы стационаров). |
Имеется информация обо всех
назначениях и последствиях применения ЛС. Позволяет выявлять частоту
возникновения НПР. |
Малочисленность наблюдений.
Дороговизна метода. |
|
III.
|
Мониторинг взаимосвязи «назначение ЛС - НПР»
с помощью учета рецептов |
Учитываются все назначения нового (после
регистрации) ЛС. Контакт с врачами, которые выписывали рецепты. Проводится
регистрация всех событий у больного на фоне приема ЛС. |
Выявление неожиданных НПР, летальных исходов и
влияния на беременность. НПР с длительным латентным периодом, других явлений
и событий. Определение частоты возникновения НПР.
Возможно проведение исследования за короткий период. Относительная
дешевизна. |
Отсутствие группы сравнения. Ограниченное
число пациентов.
Не учитывается соблюдение больными рекомендаций по применению ЛС. |
|
IV.
|
Исследование типа «случай-контроль» |
Идентифицируются больные с определенным
заболеванием или НПР. Идентифицируются больные, у которых нет этих
заболеваний или НПР.
Сравнивается частота применения ЛС. |
Позволяет выявлять редкие, серьезные НПР,
эффекты препаратов с длительным латентным периодом. Позволяет быстро
оценить выдвигаемую гипотезу.
Позволяет оценить влияние многих факторов.
Позволяет оценить относительный риск применения ЛС.
Относительно низкая трудоемкость и стоимость. |
Позволяет выявлять только конкретные НПР,
заболевания. Затруднен подбор пациентов.
Трудности оценки степени достоверности взаимосвязи ЛС и НПР.
Не позволяет определять частоту возникновения НПР. |
|
V.
|
Когортные исследования |
Когорта пациентов от 5 до 10 тыс. получает ЛС.
Группа больных, получающих ЛС.
Контрольная группа.
Через определенный период времени сравниваются результаты (эффекты и НПР). |
Позволяет выявлять одновременно несколько, в
том числе и неожиданные НПР. Позволяет определять частоту возникновения
НПР.
Позволяет определять степень абсолютного и относительного риска.
Позволяет выявлять факторы риска и взаимодействия ЛС. |
Дорогостоящий. Продолжительный во времени. |
|
VI.
|
Метод, основан на учете всех сведений о
пациенте |
Анализ данных (диагнозы, лечение, исходы и
т.д.) из компьютеризированных регистров записей о больном с момента рождения
и до смерти. Учет назначений препарата, НПР, исходов терапии. |
Позволяет выявлять отсроченные эффекты,
внезапные летальные исходы, неожиданные эффекты. Возможность быстро
провести исследование.
Относительно дешевый.
Возможность сочетания с любым другим методом. |
Неполные и недостоверные данные о пациентах. |
|
VII.
|
Мета-анализ |
Суммируются результаты
опубликованных исследований. |
Увеличивается статистическая
значимость результатов. Идентифицируются источники вариаций в результатах
исследований. |
Гетерогенность включенных в анализ
исследований. |
Аспирин был внедрен в медицинскую практику в 1899 г., и только в 1938 г. было
установлено, что он может вызывать эрозивное поражение желудка.
Проведенный исследователями анализ результатов амбулаторной фармакотерапии
свидетельствует о высокой частоте развития НПР при применении ЛС. Единодушной
позиции в этом вопросе нет, и результаты разных авторов имеют значительные
отличия. Тем не менее, многие исследователи показывают, что при развитии
неблагоприятных (побочных) реакций при применении лекарственных средств лишь
небольшая часть пациентов обращается за медицинской помощью (Петров В.И., 2011).
В большинстве случаев это заканчивается временной нетрудоспособностью, а в
худшем случае приводит к стойкой утрате трудоспособности или даже к смерти (рис.
4.3).
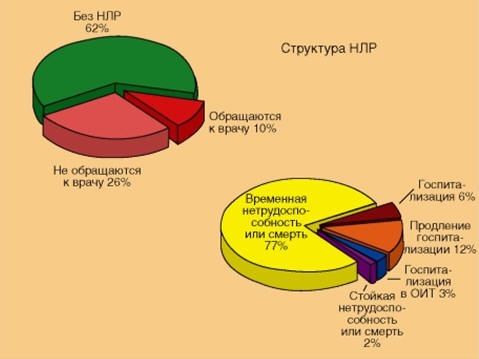
Рис. 4.3. Структура неблагоприятных (побочных) реакций при применении
лекарственных средств (приведено по «Петров В.И. Клиническая фармакология и
фармакотерапия в реальной врачебной практике. - 2011. - 880с.»)
Обеспечение безопасности применения ЛС, должно стать неотъемлемой частью
широкой клинической практики. Для осуществления программ безопасного применения
ЛС необходим сбор информации по данной проблеме, причем поток информации должен
быть регулярным и достоверным, а кроме того он должен обеспечивать возможность
для выявления пробелов в нашем понимании механизмов ятрогенных синдромов,
спровоцированных или вызванных фармакотерапией.
Наиболее распространенным методом сбора выше указанной информации является
метод спонтанных сообщений (МСС).
Метод спонтанных сообщений многие годы является основным в работе
служб контроля безопасности лекарств во всех странах мира, в том числе и в
России. Согласно этому методу медицинские работники разных специальностей
добровольно или в соответствие с законодательными требованиями, соответствующие
контрольно-разрешительные органы здравоохранения о выявляемых НПР. На базе
поступающих сообщений формируются база данных о формировании и
причинно-следственных связях НПР и гипотезы, которые в дальнейшем проверяются и
уточняются с помощью специальных исследований. МСС особо эффективен в выявлении
реакций типа А и В.
Применение МСС объясняется, прежде всего, тем, что он имеет целый ряд
преимуществ перед другими, к числу которых в первую очередь относится частота
его реализации на практике. Кроме того, он не требует больших материальных
затрат. К достоинствам метода относятся также возможность контролировать
терапевтические и побочные эффекты ЛС с начала его появления в широкой
медицинской практике. МСС позволяет охватить большое число пациентов и ЛС,
стационаров и поликлиник. Однако данная система сбора информации о НПР не лишена
и недостатков:
-
не позволяет выявлять весь спектр НПР, вызываемых ЛС,
например, не эффективен там, где речь идет об отсроченных осложнениях
(канцерогенных эффектах);
-
практикующие врачи сообщают не обо всех выявляемых НПР и др.
Даже в странах с хорошо отлаженной системой контроля безопасности лекарств, к
которым относятся Австралия, Новая Зеландия, Великобритания, Швеция, Канада,
присылается не более 10% сообщений от числа выявляемых серьезных НПР. Они
отнесены к категории стран с высоким уровнем сообщаемости о НПР (200 сообщений
на 1млн. жителей или 100 сообщений на 1000 врачей. Во многих странах
эти цифры гораздо ниже. Недостаточный уровень числа
сообщений о НПР ведет к задержке выявления новых, серьезных НПР и, как
следствие, недооценке частоты их возникновения и запаздыванию в принятии
решений, направленных на их предупреждение.
Интенсивный мониторинг в стационаре. Принцип метода основан на
получении всеобъемлющей информации (медицинской, демографической, социальной,
причины госпитализации) о больных одного или нескольких стационаров. Под
контролем находятся все больные, учитываются все назначаемые лекарства и все
подозреваемые неблагоприятные побочные реакции.
Исследования, проведенные с помощью данного метода в разных странах мира,
позволили прийти к выводу о том, что частота развития неблагоприятных побочных
реакций в действительности выше, чем предполагается. Этот метод позволяет
определить частоту НПР, так как известны составляющие для ее определения, кроме
того с его помощью появляется возможность отследить НПР, связанные с
взаимодействием ЛС.
С помощью метода интенсивного мониторинга в стационаре можно решать и более
конкретные задачи, например, провести исследование с целью определения влияния
ЛС на отдельные группы пациентов или определения влияния определенных групп ЛС,
что позволяет осуществлять сравнительные исследования. Однако, и этот метод не
лишен недостатков. Он требует значительных затрат, в то же время ограничен по
числу участников, что не позволяет с достаточной степенью вероятности рассчитать
риск НПР. К достоинствам метода интенсивного мониторинга НПР в стационаре
относятся: возможность избежать недостатков, присущих методу спонтанных
сообщений, применение клинических критериев для отбора пациентов в изучаемую
группу и получение более достоверной информации.
Мониторинг взаимосвязи «назначение ЛС - НПР» с помощью учета рецептов.
Метод, впервые предложенный в 1981 году, основан на учете назначений ЛС по
числу выписанных рецептов (МУВР). Он наиболее широко используется при изучении
новых препаратов, поступающих в широкую медицинскую практику после их
регистрации. Он оказался высокоэффективным, при котором в работу
вовлекается около 75 % врачей общего профиля. При этом
методе в течение определенного периода времени идентифицируются все больные,
которые получают препарат, выбранный для изучения. Он был многократно применен,
например, в Великобритании, с целью подтверждения и опровержения гипотез,
касающихся НПР, выявленных в процессе клинических испытаний препарата.
МУВР следует отличать от исследований фазы клинических испытаний и так
называемых «насаждающих» (seeding) испытаний.
Исследования, проводимые на фазе клинического изучения препаратов, — это обычно
контролируемые рандомизированные исследования, проводимые на относительно
небольшом числе больных. «Насаждающие исследования» — это исследования, в
которые для изучения препарата вовлекается много врачей, но у каждого отдельного
врача таких больных, которые получают выбранный для наблюдения препарат,
немного. «Насаждающие исследования», как правило, мало информативны с научной
точки зрения. Они проводятся в основном для ознакомления с препаратом большого
числа врачей. С помощью данного метода обычно проводится изучение новых,
поступивших на рынок после регистрации препаратов, приблизительно на 10 000
пациентов.
Схематично сущность метода МУВР можно представить следующим образом. Врачам,
участвующим в исследовании, раздается специальный вопросник в виде
«формы-карты». В этой карте, помимо вопросов, имеется информация разъяснение.
Врачу предлагается отмечать все события- явления, которые возникли у больных в
период лечения препаратом, находящимся на изучении. В карте имеется пояснение
относительно того, что такое «событие-явление», которые классифицированы на
группы (явления со стороны кожи, почек и т.д.), а также другая нужная
информация, которая заносится в компьютерную базу данных (имя, адрес больного,
дата выписки рецепта, имя и адрес врача).
Под «явлениями» подразумеваются все события и клинические проявления,
возникшие у больного на фоне применения препарата: любые новые симптомы,
заболевания, причины, послужившие основанием для обращения к врачу и для
госпитализации, например, для проведения операции по поводу травмы или
наступившей беременности. Регистрации подлежат и неожиданные обострения (или
улучшения) сопутствующих заболеваний, любые подозреваемые НПР и любые другие
жалобы, т.е. речь идет о необходимости учета всего того, что происходит с
больными. Врач должен указать также показания к назначению препарата,
отметить каким был эффект или указать на его отсутствие. Затем заполненные
вопросники врачи направляют в адрес национальных центров по контролю
безопасности лекарств.
Вся полученная информация заносится в компьютер, затем проводится ее анализ с
определенной периодичностью: после того, как численность наблюдаемых пациентов
(когорта больных) достигает 2 500 человек, 5 000, 7 500 и по завершении
исследования (приблизительно 10 000 больных).
Исследование типа «случай-контроль». Принципом метода является
идентификация пациентов с определенным заболеванием или НПР. Параллельно
идентифицируются больные, у которых нет этих заболеваний или НПР и сравнивается
частота применения ЛС.
Этот метод позволяет выявлять редкие, серьезные НПР, эффекты препаратов с
длительным латентным периодом, а так же позволяет быстро оценить выдвигаемую
гипотезу, проводить оценку влияния многих факторов и относительный риск
применения ЛС. Отличает метод «случай-контроль» относительно низкая трудоемкость
и стоимость.
Как и у предыдущих методов он имеет недостатки. Во-первых он позволяет
выявлять только конкретные НПР при конкретных заболеваниях. Во-вторых, как
правило затруднен подбор пациентов. В-третьих имеются затруднения оценки степени
достоверности взаимосвязи применения ЛС и развития НПР, что не позволяет
определять частоту возникновения НПР.
Когортные исследования, которые именуются еще как контролируемые
наблюдения, это такие исследования, при которых подбираются 2 большие группы
больных для сравнения. Пациенты одной группы получают исследуемый препарат,
больные контрольной группы этого препарата не получают. По прошествии
определенного периода времени оцениваются результаты применения препарата с
целью выявления НПР. Данный методический подход позволяет выявить частоту
возникновения НПР, сравнить частоту возникновения НПР (например, при разных
заболеваниях), оценить степень абсолютного риска развития НПР. Стандартные
когортные исследования, так же как и исследования типа «случай-контроль», могут
быть ориентированы на изучение кумулятивных эффектов в результате длительного
применения препаратов. Когортные исследования являются базовыми в
фармакоэпидемиологии, они могут быть ретроспективными и проспективными. Метод
также широко используется для изучения препаратов, которые поступили в широкую
практику после их регистрации.
В основу метода «когортного исследования» положено следующее:
- Наблюдение в течение определенного времени за больными, которые
принимали конкретный изучаемый препарат.
- Наблюдение в течение определенного периода времени за больными, которые
не получали конкретный изучаемый препарат.
- Оценка частоты возникновения НПР (одной или нескольких) в обеих
группах.
К достоинствам метода следует отнести то, что он
позволяет выявить риск возникновения НПР, определять абсолютный и относительный
риск, выявлять факторы риска и взаимодействия, а так же выявлять одновременно
многие НПР и их частоту. Что же относительно недостатков,
то это трудоемкость, значительная стоимость и продолжительность по
времени проведения.
Мета-анализ. Этот методический подход основан на
анализе и суммировании результатов опубликованных данных, полученных в
нескольких специальных исследованиях, посвященных определению эффективности
препаратов, выявлению НПР или определению частоты их развития. Он позволяет
повышать статистическую значимость полученных результатов и выявлять причины их
вариабельности. К недостаткам «мета-анализа» относятся гетерогенность, разный
уровень организации и проведения исследований, которые берутся для анализа.
Анализ принципов, достоинств и преимуществ методов выявления и изучения НПР
показывает, что идеальной методики выявления НПР в настоящее время не
существует, что в условиях продолжающихся работ по индивидуализации (персонализации)
фармакотерапии, формирует определенные надежды. Очевидно, что персонализация
применения ЛС может оказать существенное влияние на частоту развития
нежелательных реакций, в т.ч. со смертельным исходом. Поэтому использование
подобного подхода в практическом здравоохранении поощряется и поддерживается
Еврокомиссией и FDA.
В настоящее время наиболее близким к клинической практике направлением
развития персонализированной медицины является персонализированный выбор ЛС на
основе изучения генетических особенностей пациентов, или фармакогенетический
подход к медикаментозной терапии. Это связано с тем, что именно генетические
особенности пациентов в наибольшей степени определяют «фармакологический ответ»
на применение ЛС и, прежде всего, развитие НПР. Выявление генетических
особенностей пациентов позволит врачу индивидуально подбирать наиболее
эффективные и безопасные ЛС из определенных групп, а также их дозу (фармакогенетический
подход). В то же время это ни в коей мере не решает проблему так называемых
«скрытых НПР».
Скрытые неблагоприятные побочные реакции. В сложившейся ситуации
реализация методов выявления, регистрации и системного анализа
причинно-следственных связей неблагоприятных побочных реакций на применение
лекарственных средств, как правило, касается тех НПР, клиническую картину
которых может диагностировать лечащий врач. Однако ещё в 1976 г. D.W
Vere первым описал способность неблагоприятных реакций
лекарственных средств выступать под маской обычных заболеваний (Vere D.W.,
1976), указав пять основных причин этого явления.
Реакция может быть настолько странной или причудливой, что часто
используемый и явно безобидный препарат не вызывает подозрения.
Нарушения, вызванные лекарством, могут в точности имитировать обычное
заболевание.
Существуют длительные задержки проявлений неблагоприятных реакций.
Лекарство провоцирует обострение обычных заболеваний или может
провоцировать проявление генетически предрасположенных нарушений.
Клиническая ситуация может быть настолько сложной, что ее составляющие,
связанные с препаратами, остаются незамеченными.
Спустя несколько десятилетий прошедших после сообщения D.W
Vere, ятрогенные заболевания довольно часто остаются нераспознанными
несмотря на то, что продолжается планомерное улучшение работы органов
фармаконадзора в большинстве стран мира. В этой связи следует признать, что
большинство важных и современных наблюдений за НПР делается практикующими
врачами, хотя многие НПР хорошо маскируются.
Биологическая система – организм человека обладает ограниченными
возможностями ответа на вредные стимулы, независимо от того, являются ли они
вирусами, бактериями или ксенобиотиками (включая лекарства). Однако не
удивительно, что патологические изменения, вызываемые неблагоприятными реакциями
на некоторые ксенобиотики/ лекарства, могут быть неотличимы от вызванных
идиопатическим заболеванием или болезнями, вызываемыми другими причинами.
Например, идиопатический интерстициальный цистит в течение многих десятилетий
являлся типичным заболеванием женщин среднего возраста, при котором в стенке
мочевого пузыря выявлялись воспалительные явления, что приводило к сокращению
гладкой мускулатуры, уменьшению объема пузыря и частым симптомам дизурии и
гематурии. Этиология этого заболевания была неизвестна и лечение довольно часто
не сопровождалось не только выздоровлением, но и улучшением. Только в 1991 г.
было получено первое сообщение о распознанном случае тяжелого цистита,
сочетающегося с приемом нестероидного противовоспалительного препарата
тиопрофеновой кислоты (Allilied М.,
Davison O.W., 1991).
Затем в течение последующих лет предположение, высказанное
Allilied М., Davison O.W.,
о причинно-следственной связи приема тиопрофеновой кислоты и развитии цистита
было паодтверждено в результатах нескольких исследователей (Gliose
K., 1993; Greeiie
G.F. et
al.,1994; Harrison
W.J.,
Willis R.G.,
Neal D.E.,
1994; O’Neil
G.F., 1994).
После этого комитет по безопасности лекарств Великобритании получил ещё 69
сообщений о циститах и 32 сообщения о других симптомах заболеваний мочевых
путей, указывающих на цистит в сочетании с приемом тиопрофеновой кислоты,
начиная с 1982 г. (Anon., 1994). Некоторые пациенты,
принимавшие тиапрофеновую кислоту, подверглись хирургическому вмешательству,
включая тотальную цистэктомию. Вполне естественно, что существовали значительные
вариации во времени начала заболевания, но если заболевание распознавалось рано,
то отмена препарата обычно приводила к быстрому выздоровлению. Однако в силу
обстоятельств и рутинного взгляда на происхождение цистита, которое многими
практикующими врачами не связывалось с лечением тиапрофеновой кислотой,
большинству пациентов продолжали длительное лечение ею, вопреки весьма точно
описанной клинике НПР. Усугубляет ситуацию отсроченное начало клинических
проявлений НПР. Следовательно, если задержка начала ягрогенного проявления
велика, то отсроченные эффекты определить еще труднее. Так аутоиммунная
гемолитическая анемия была описана после 9 лет лечения а-метилдопой (Terol
M.J.,
Cervantes F., Pereira
A., Rozman
C., 1998).
Существуют ЛС, которые вызывают патологические синдромы у лиц с генетической
предрасположенностью, также могут не попасть под подозрение, особенно если
картина заболевания является превалирующей (McKenzie
R., 1995). Наконец, распознание неблагоприятных
лекарственных реакций может быть затруднено из-за эффектов параллельно
проводимой терапии. Кроме того, значительное число ЛС, применяемых в психиатрии,
так или иначе, оказываю влияние на психологический статус, настроение и
самочувствие пациентов. Именно в этих случаях существует весьма тонкая грань
между патологическими проявлениями основного заболевания и ятрогенного синдрома,
связанного с применением лекарственных препаратов (Ashton C.H., Young A.H.,
1998; Harry T. C., Matthews M., Salvary I., 2000).
В ходе реализации индивидуальной фармакотерапии может возникнуть
неблагоприятная реакция, сведения о природе и тяжести которой отсутствуют в
инструкции по применению препарата, и ее не ожидают на основании существующих
знаний о свойствах лекарственного средства. В этих случаях побочная реакция на
препарат наблюдается впервые и является неизвестной. Такая реакция трактуется
как неожиданная неблагоприятная реакция (Хубиева М.Ю. с соавт., 2008).
Неожиданную неблагоприятную реакцию следует отличать от неблагоприятного
явления (негативного проявления). Негативное проявление - любое неблагоприятное
клиническое проявление, выявленное у больного или испытуемого, которому было
введено лекарственное средство, независимо от наличия причинно-следственной
связи с его применением. Негативным проявлением могут быть любые нежелательные
или непредвиденные симптомы (включая патологические изменения, обнаруженные
лабораторно), жалобы или заболевания, которые связаны во времени с применением
лекарственного средства, независимо от наличия причинной связи с его применением
(Кукес В.Г., 2006).
Именно в сложившейся ситуации повышается значение определение степени
достоверности причинно-следственной связи НПР с применяемым лекарственным
средством, что становится важным фактом решения вопроса о силе и качестве
«сигнала» о ятрогенном синдроме и важным этапом оценки сообщений о НПР. Степень
достоверности взаимосвязи лекарственного средства с возникшей неблагоприятной
побочной реакцией должна приниматься во внимание и при подготовке научных
публикаций, и особенно таких, в которых даются какие-либо рекомендации по
ограничению или запрещению применения ЛС. Оценка степени достоверности важна в
работе по обмену информацией между специалистами и организациями, имеющими
отношение к фармаконадзору: Национальные центры по контролю безопасности
лекарств; фармацевтические кампании; ВОЗ; Европейское медицинское агентство и
др.
Классификация степени достоверности НПР. Одной из задач
фармаконадзора является оценка и систематизация поступающих сообщений о
неблагоприятных побочных реакциях (НПР) согласно определенным рабочим процедурам
- инструкциям. В результате разнообразия НПР, могут возникнуть трудности в
определении степени достоверности причинно-следственной связи «НПР ̶ лекарство»
при использовании алгоритма (шкалы) Наранжо. В связи с этим, допускается
применение других методов определения степени достоверности. В странах ЕС
используется упрощенная классификация, именуемая «система АВО», при которой
выделяют только три степени достоверности взаимосвязи лекарства и препарата
Несмотря на имеющиеся различия в классификациях, используемых в Национальных
центрах по контролю безопасности лекарств, ВОЗ и странах ЕС, процедуры в
определении степени достоверности в значительной степени сходны. Предложенная С.
Benichou (1994) модель-схема определения взаимосвязи лекарства с возникшей
побочной реакцией, основана на учете этиологических и диагностических признаков.
Речь идет о постановке диагноза – «заболевание, вызванное препаратом». В этой
схеме-модели присутствуют:
постановка диагноза предполагаемого заболевания лекарственного
происхождения (например, поражение печени);
клинические проявления этого заболевания;
степень тяжести;
этиология (возможные причины его появления);
доказательства причастности лекарства;
учет хронологического фактора;
меры коррекции "заболевания, вызванного препаратом", лечение.
Значимость стандартизованных критериев при оценке степени достоверности может
варьировать в зависимости от различных типов НПР, и поэтому сходные ответы на
один и тот же вопрос в разных случаях неравнозначны. Например, глухота,
вызванная ацетилсалициловой кислотой, обычно носит транзиторный характер, а
вызванная антибиотиками аминогликозидного ряда - необратима.
Совпадение НПР со временем приема препарата имеет значение при рассмотрении
реакций гиперчувствительности немедленного типа, но этот показатель не столь
важен в случае возникновения отсроченных НПР. В связи с этим оценка каждого
отдельного сообщения с целью определения степени достоверности по-прежнему во
многом зависит от опыта и знаний эксперта.
К недостаткам стандартизированных подходов можно отнести то, что, они
малоэффективны при выявлении взаимосвязи НПР с новым оригинальным препаратом,
так как отрицательный ответ на вопрос «является ли наблюдаемая НПР известной и
были ли ранее сообщения о таких реакциях» сразу снижает значимость такого
методического подхода.
Определение степени достоверности взаимосвязи «лекарство ̶ НПР», проводимое
по этиологическому и диагностическому признакам, при котором выстраивается
модель «заболевание, вызванное препаратом», тоже не может быть применима ко всем
случаям НПР. Но, несмотря на указанные недостатки, данный метод оценки сообщений
о НПР может быть практически значим.
Существует альтернативная классификация степеней достоверности
причинно-следственной связи приема лекарства с возникшей побочной реакцией,
предложенная ВОЗ (WHO., 1991). Эта классификация
включает 6 степеней достоверности: достоверную, вероятную, возможную,
сомнительную, условную и не подлежащую классификации.
Достоверная — клинические проявления, включающие нарушения
лабораторных показателей, возникающие в период приема препарата и которые не
могут быть объяснены наличием существующих заболеваний и влиянием других
факторов и химических соединений. Проявления побочной реакции регрессируют после
отмены лекарства и возникают при повторном назначении.
Вероятная — клинические проявления, включающие нарушения лабораторных
показателей, связанные по времени с приемом лекарства, которые вряд ли имеют
отношение к сопутствующим заболеваниям или другим факторам и которые
регрессируют с отменой препарата. Ответная реакция на повторное назначение
неизвестна.
Возможная — клинические проявления, включающие нарушения лабораторных
показателей, связанные по времени с приемом препарата, но которые можно
объяснить наличием сопутствующих заболеваний или приемом других лекарств и
химических соединений. Информация о реакции на отмену лекарства неясная.
Сомнительная — клинические проявления, включающие нарушения
лабораторных показателей, которые возникают при отсутствии четкой временной
связи с приемом лекарства; присутствуют другие факторы (лекарства, заболевания,
химические вещества), которые могут быть причиной их возникновения.
Условная — клинические проявления, включающие нарушения лабораторных
показателей, отнесенные к «побочным реакциям», которые нуждаются в получении
дополнительных данных (для точной оценки) или же эти полученные данные в
настоящее время анализируются.
Не подлежащая классификации — сообщения о подозреваемой побочной
реакции нельзя оценивать, так как нет достаточной информации или же она
противоречива.
В большинстве случаев побочные эффекты у стационарных больных
терапевтического профиля обусловлены применением антибиотиков, сердечных
гликозидов, диуретических средств, анальгетиков, антиаритмиков,
противодиабетических препаратов, транквилизаторов.
Чаще всего побочные эффекты проявляются нарушением функций
желудочно-кишечного тракта, печени, почек, легких, сердечно-сосудистой системы,
изменениями кожи, поражениями соединительной ткани и мускулатуры, глаз,
нарушениями гемопоэза или свертываемости крови, аллергическими реакциями и
психическими нарушениями.
Очень многие лекарства вызывают желудочно-кишечные расстройства в виде
тошноты, рвоты, запора, диареи. Ряд препаратов может обусловить повреждения
слизистой оболочки желудка, тонкой кишки (глюкокортикостероиды, нестероидные
противовоспалительные средства, метотрексат), вызвать обострение хронического
панкреатита (диуретики, глюкокортикостероиды, противозачаточные средства и др.).
В принятии решений о применении санкций к зарегистрированному лекарственному
средству в первую очередь учитываются те реакции, которые классифицируются как
«определенные» (что бывает относительно редко) и «вероятные», а такие категории,
как «возможные», «сомнительные», как правило, исключаются. В случае рассмотрения
новых препаратов может учитываться и категория «возможная», поскольку в этой
ситуации на первый план выходит то, что наблюдаемая НПР является новой (Хубиева
М.Ю. с соавт., 2008). В связи с тем, что доклинические и клинические испытания
не позволяют выявить весь спектр возможных НПР и частоту их развития, очевидна
необходимость продолжения исследований и оценки НПР на лекарственные препараты
после их регистрации. С этой целью во многих странах стали создаваться
специальные центры и службы по контролю безопасности лекарств.

