Данная информация предназначена для специалистов в области здравоохранения и фармацевтики. Пациенты не должны использовать эту информацию в качестве медицинских советов или рекомендаций.
Диагностика
Рентгенологическое исследование
Диагноз ПБ не может быть установлен при рентгенологическом исследовании. Этот
метод используется лишь для выявления грыжи пищеводного отверстия диафрагмы у
больных с ПБ.
Эндоскопическое исследование
В течение многих лет «золотым стандартом» эндоскопической диагностики ПБ
являлась эзофагогастродуоденоскопия с множественной 4-х квадрантной биопсией
измененной слизистой оболочки пищевода с интервалом в 2 см. [1]. Однако, в
настоящее время доказано, что рутинная эзофагоскопия позволяет лишь высказать
предположение о наличии ПБ, но ее диагностическая точность в выявлении именно
КМ эпителия слизистой оболочки пищевода, дисплазии эпителия, равно как и
ранней аденокарциномы, не превышает 60%[70, 77]. Косвенными эндоскопическими
признаками диспластических изменений эпителия слизистой оболочки ПБ могут
служить изменения цвета и рельефа, причем на очень ограниченных участках -
диаметром 2-3 мм: очаги гиперемии с подчеркнутым сосудистым рисунком, ее
очаговые утолщения или мелкие углубления, эрозированные и изъязвленные участки
в пределах сегмента ПБ [1].
Однако, принимая во внимание трудоемкость множественной биопсии, необходимость
обработки и оценки большого объема морфологического материала, и более чем
80%-вероятность пропуска фокусов дисплазии и ранней аденокарциномы на фоне ПБ,
подобный протокол сложно рекомендовать в качестве стандартного. [104].
С целью повышения точности диагностики ПБ в течение последних 10 лет
предпринимались попытки использования хромоэндоскопических методик, в
частности окраски слизистой оболочки пищевода раствором Люголя или
метиленового синего. Использование хромоэндоскопии с раствором Люголя
обеспечивает интенсивное окрашивание плоского эпителия пищевода в
темно-коричневый цвет при отсутствии окраски сегмента метаплазированного
эпителия, что позволяет четко визуализировать проксимальную его границу.
Однако при этом все варианты метаплазированного эпителия, а также рубцовые и
эрозивные изменения визуализируются как участки неокрашенной слизистой
оболочки пищевода, что в результате обеспечивает невысокую диагностическую
точность диагностики ПБ – 56,1%. Метиленовый синий, по мнению ряда авторов,
специфичен в отношении кишечной метаплазии и может быть использован для
диагностики ПБ. Однако, согласно данным последних исследований хромоэндоскопия
с метиленовым синим не обеспечивает ни высокой чувствительности (47,5%), ни
высокой специфичности (54,8%) диагностики ПБ и ранней неоплазии на его фоне
[70, 104].
В настоящее время для уточняющей эндоскопической диагностики ПБ применяются
высокочувствительные эндоскопические технологии: эндоскопия с высоким
разрешением (до 1 млн пикселей) в комбинации с узкоспектральной эндоскопией
NBI, в том числе и с оптическим увеличением до 150 раз, а также – методы
эндоскопии сверхвысокого увеличения, в частности - конфокальная лазерная
эндомикроскопия (КЛЭ)[41, 42, 124].
Узкоспектральная эндоскопия (NBI – Narrow Band Imaging) – эндоскопическая
технология, в основе которой лежит освещение слизистой оболочки световым
пучком с узким спектральным диапазоном и длиной волны 415 +/- 30 нм
(исключение красной составляющей из спектра излучаемого эндоскопом света), что
позволяет контрастировать капиллярный рисунок и архитектонику ямок слизистой
оболочки ПБ. При использовании NBI можно выделить 5 типов архитектоники ямок
метаплазированного железистого эпителия в пищеводе: виллезный (в виде «черепичек»),
гребенчатый (удлиненные гребни) церебральный («мозговидный»), овальный
(округлый) и нерегулярный (стертый) (рис. 1А). При этом, виллезная
архитектоника ямок слизистой оболочки пищевода может соответствовать кишечной
метаплазии плоского эпителия, церебральная – кардиальному желудочному
эпителию, овальная – фундальному желудочному эпителию и нерегулярная или
отсуствующая – тяжелой дисплазии эпителия П Б и ранней аденокарциноме на его
фоне [104, 105]. Наилучшие результаты получаются при сочетании
узкоспектральной эндоскопии (NBI) с инстилляцией 1,5% раствора уксусной
кислоты. При таком методе исследования достигается высокая точность
дифференциальной диагностики различных типов метаплазированного эпителия в
пищеводе, включая участки эпителия с неопластической прогрессией [70].
Наибольшую диагностическую точность в выявлении ранних неопластических
изменений слизистой оболочки ПБ представляет сочетание оптической
увеличительной эндоскопии в 150 раз с технологией NBI. Подобное комплексное
исследование позволяет не только визуализировать архитектонику ямок слизистой
оболочки ПБ, но и оценивать структуру капиллярной сети, выявлять изменения
формы, размера, упорядоченности расположения капиллярных петель. Выявление
значительной гетерогенности, расширения, деформации IPCL может
свидетельствовать о наличии неопластических изменений эпителия в исследуемом
участке слизистой оболочки ПБ [104] (рис. 1B).
Перед выполнением комплексного эндоскопического исследования с забором
биопсийного материала гастроэнтеролог должен назначить курс антисекреторной
терапии ИПП для уменьшения степени воспалительной инфильтрации слизистой
оболочке ПБ, затрудняющей диагностику диспластических изменений эпителия.
В последние несколько лет для широкого использования были представлены методы
эндоскопии сверхвысокого увеличения, позволяющие уменьшить количество
выполняемых биопсий и, в ряде исследований – полностью отказаться от них при
ПБ. Одной из таких методик является КЛЭ, позволяющая непосредственно в
процессе эндоскопического исследования получать изображения слизистой
оболочки, сходные с гистологическими - с увеличением до 1000 раз [106, 124]
(рис. 1C).
Точность данного исследования в сочетании с эндоскопией высокого разрешения в
определении типа метаплазированного эпителия в пищеводе, оценки наличия
различных этапов неопластической прогрессии ПБ приближается к 100%. При
выявлении КМ слизистой оболочки пищевода на эндомикроскопическом и зображении
четко визуализируются темные бокаловидные клетки и эпителиоциты кишечного типа
с вытянутыми ядрами. Дисплазия высокой степени в пределах сегмента ПБ при КЛЭ
характеризуется увеличением, полиморфизмом ядер эпителиоцитов, нарушением
полярности их расположения и, в отдельных случаях – формированием
конгломератов из крупных полиморфных ядер [124].
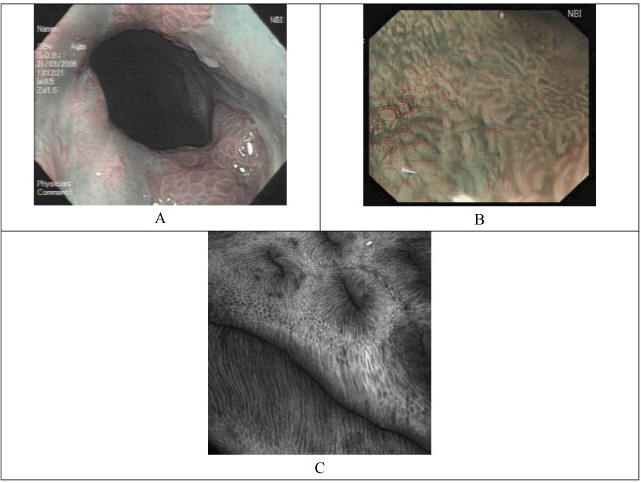
Рис. 1. Эндоскопическая диагностика ПБ.
А. Эндоскопическое исследование в режиме NBI – виллезная архитектоника
ямок слизистой оболочки в пределах сегмента метаплазированного эпителия –
признак КМ.
B. Эндоскопическое исследование в режиме NBI с увеличением в 150 раз–
нерегулярная архитектоника ямок и деформация внутрисосочковых капиллярных петель
– признак дисплазии эпителия высокой степени в пределах сегмента ПБ
C. Эндомикроскопия (увеличение х1000) – темные бокаловидные клетки и
удлиненные ядра эпителиоцитов кишечного типа – признак КМ
При эндоскопическом исследовании сегмент метаплазии в пищеводе, принято
разделять на длинный - распространение метаплазированного эпителия в пищеводе на
3 см и более, короткий - от 1 до 3 см и ультракороткий– при распространении
метаплазии менее чем на 1 см проксимальнее уровня истинного кардиоэзофагеального
перехода (КЭП) [70,88].
Однако, на сегодняшний день показано, что выделение в отдельное понятие
«ультракороткого сегмента ПБ» не оправдано, так как в большинстве (93,1%) этих
случаев метаплазия в пищеводе представлена желудочными ее типами с низким
потенциалом малигнизации [70,88,89,90,91].
Важно, что обнаружение очагов КМ ниже или на уровне КЭП не должно
расцениваться, как ПБ, так как в таких наблюдениях имеют место другие
этиопатогенетические механизмы, например инфицирование H.pylori, наследственные
факторы, и все случаи аденокарциномы ниже или на уровне КЭП должны быть отнесены
к раку желудка (типы II и III по классификации J.Siewert), а не пищевода на фоне
ПБ. [92, 93,94, 107].
Четкое определение уровня истинного КЭП крайне необходимо для адекватной
оценки длины сегмента метаплазированного эпителия и соответственно выявления
пациентов группы риска развития АКП. В качестве критерия КЭП необходимо
использовать дистальный край палисадных сосудов слизистой оболочки пищевода или
уровень проксимального края складок кардиального отдела желудка [70,26,27,28].
Однако, в ряде случаев, определение уровня КЭП затруднено, что обусловлено
наличием более чем у половины пациентов с подозрением на ПБ таких осложнений
ГЭРБ, как дистальный рефлюкс-эзофагит и эрозивно-язвенное поражение пищевода,
что осложняет визуализацию сосудистой архитектоники слизистой оболочки. У ряда
пациентов с протяженными аксиальными или фиксированными
аксиально-параэзофагеальными грыжами ПОД определить уровень проксимального края
складок кардии представляется затруднительным вследствие их сглаживания. Таким
образом, при оценке истинного уровня КЭП необходимо использовать оба
вышеописанных критерия[70].
Для оценки циркулярного (С) поражения и максимальной протяженности (М) по
складкам ПБ применяются Пражские критерии (The Prague C&M Criteria) (рис.
2). Данная система оценки степени распространенности КМ имеет высокий (72)
коэффициент надежности в случае сегмента метаплазии, длиной более 1 см. При
ультракоротком сегменте метаплазированного эпителия коэффициент надежности резко
снижается до 0,22[71].
Циркулярное поражение выше 3 см от кардии и , «язычок» протяженностью 5 см
выше кардии описываются как С3 М5, «язычок» на 3 см проксимальнее КЭП без
циркулярного поражения – как С0М3 [26,71].
![Рис. 2. Оценка циркулярного (С) поражения и максимальной протяженности (М) цилиндроклеточной метаплазии согласно Пражским критериям[71]](images/art/all23/new_pa318.jpg)
Рис. 2. Оценка циркулярного (С) поражения и максимальной протяженности (М)
цилиндроклеточной метаплазии согласно Пражским критериям[71]
Гистологическое исследование
При наличии в пищеводе активного воспаления с развитием эрозий и язв
необходимо проводить биопсию после курса антисекреторной терапии, что позволит
избежать ложноположительных результатов в отношении наличия дисплазии эпителия.
Биопсия должна выполняться из любого патологически измененного участка
слизистой оболочки ПБ, включая эрозии, язвы, полиповидные, узловые изменения или
стриктуры.
ПБ подтверждается данными гистологического исследования, когда в биоптатах
обнаруживают КМ цилиндрического эпителия кардиального (только со слизистыми
железами) или фундального (выявляются париетальные, главные и добавочные клетки
в железах, покровный эпителий формирует типичные валики, покрытые
покровно-ямочным эпителием) эпителия. Железы нередко немногочисленны, «сдавлены»
разрастаниями соединительной ткани и диффузным лимфоплазмоцитарным инфильтратом
[60].
Обязательным признаком КМ является наличие крупных бокаловидных клеток,
цитоплазма которых содержит вакуоли, заполненные слизью, которая при окраске
гематоксилином и эозином окрашивается в голубовато-синий цвет. При
морфологическом исследовании вероятность выявления КМ т.е. обнаружение
специфических бокаловидных клеток, увеличивается при использовании PAS-реакции
или окраске альциановым синим при pH раствора 2,5. Следует, однако, особенно при
таких дополнительных окрасках, дифференцировать истинные бокаловидные клетки и
псевдобокаловидные слизистые клетки.
Важно помнить, что при морфологическом исследовании биоптатов слизистой
оболочки пищевода проксимальнее КЭП возможно обнаружение трех гистологических
типов метаплазированного железистого эпителия[29]:
кардиальный желудочный эпителий (кардиальный или «переходный» тип,
представленный только слизистыми железами, а также его кислотообразующий
кардиальный подтип, в котором выявляются единичные главные и обкладочные клетки)
- неотличимый от эпителия кардиального отдела желудка фундальный желудочный
эпителий (фундальный тип) - идентичный эпителию дна и тела желудка кишечный
эпителий при КМ с характерными бокаловидными клетками (специализированный
цилиндрический эпителий). Для него также характерны ворсинчатая архитектоника,
появление клеток Панета, энтероэндокринных клеток, энтероцитов со щеточной
каемкой, всасывающая способность которых, однако, недостаточна.
Именно в аспекте возможности развития в пищеводе различных вариантов
метаплазированного эпителия крайне важно четкое указание врачом-эндоскопистом
уровня выполнения биопсии относительно КЭП, с целью исключения случаев забора
материала ниже уровня КЭП (из кардии) и, в результате – ошибочного диагноза ПБ
[70].
На сегодняшний день, только специализированный цилиндрический эпителий
принято относить к ПБ. Связано это с тем, что при развитии цилиндроклеточной
метаплазии кардиального или фундального типа, риск развития АКП не увеличивается
[95,96].
Существуют два вида КМ эпителия верхних отделов желудочно-кишечного тракта –
полная (тонкокишечная), содержащая интестинальные эпителиоциты и клетки Панета и
неполная (толстокишечная), содержащая только бокаловидные клетки[26]. Неполная
толстокишечная метаплазия обладает наибольшим злокачественным потенциалом.
При ПБ злокачественная трансформация на морфологическом уровне проходит
несколько этапов, включая КМ, неопределенную дисплазию, дисплазию низкой и
высокой степени [97] (рис. 3).
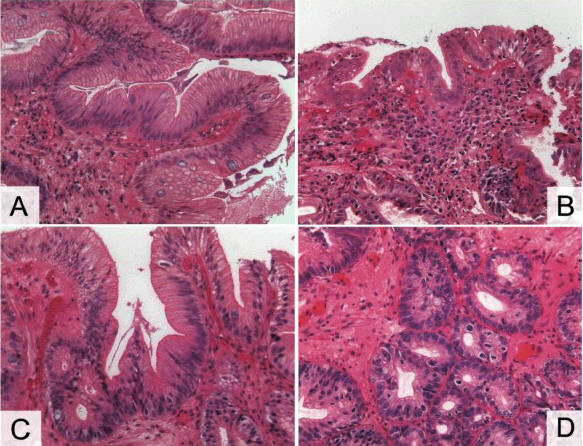
Рис. 3 A. Кишечная метаплазия без дисплазии – кардиального типа железы с
бокаловидными клетками с вакуолями со слизью, окрашенными в голубовато-синий
цвет. Цитоархитектоника не нарушена. Умеренная воспалительная инфильтрация
собственной пластинки слизистой оболочки;
B. Дисплазия I степени – выраженная воспалительная инфильтрация
собственной пластинки слизистой оболочки, ядра эпителиальных клеток увеличены,
умеренно полиморфны, железы «сдавлены» разрастаниями соединительной ткани и
диффузным лимфоплазмоцитарным инфильтратом;
C. Дисплазия II степени – полиморфные клетки эпителия с гиперхромными
ядрами, появляются митозы;
D. Дисплазия III степени – клеточная атипия представлена различной
величиной и формой клеток и их ядер, гиперхромией ядер, увеличением числа фигур
митоза, наблюдаются нарушение архитектоники желез.
А-D – окраска гематоксилином и эозином, х200 [по 97]
Для определения степени дисплазии оценивают изменения на клеточном (ядра и
цитоплазмы) и тканевом (цито- и гистоархитектоника) уровнях. Обращают внимание
на гиперхромию ядер, увеличение их в размерах, повышение
ядерно-цитоплазматического соотношения, появление многоядерных и полиморфных
клеток, увеличение числа митозов не только в базальных (крипты), но и в
поверхностных отделах желез (ворсинки), потерю полярности клеток, нарушения
формы и соотношения желез со стромой собственной пластинки слизистой оболочки, а
также сопутствующее воспаление [98,99,100,101].
Отсутствие дисплазии – регулярная цито- и гистоархитектоника, ядра не
варьируют значительно в размерах или по форме, локализованы базально, число
ядрышек в них не увеличено. Эпителий зрелый, с нормальным
ядерно-цитоплазматическим соотношением. Допустимы фокальная ядерная
стратификация и небольшое число дистрофически измененных бокаловидных клеток.
Митозы обнаруживают только в базальных (крипты), отделах желез. При воспалении
возможно появление определенного клеточного полиморфизма клеток и их ядер, рост
числа митозов (реактивные регенераторные изменения).
Неопределенная дисплазия диагностируется при выраженной воспалительной
лимфоплазмоцитарной, с различной примесью лейкоцитов и макрофагов, инфильтрации
слизистой оболочки. Дистрофические и реактивные регенераторные изменения
эпителия требуют проведения дифференциальной диагностики неопластических и
реактивных изменений. Полиморфиз клеток и их ядер выражены в меньшей степени,
чем при дисплазии. Характерно увеличение числа митозов (типичных), цито- и
гистоархитектоника в целом сохранены, но железы «сдавлены» разрастаниями
соединительной ткани и воспалительным и нфильтратом. То есть, данный вариант
дисплазии эпителия можно считать реактивным, развившимся вследствие
воспалительных изменений слизистой оболочки.
Дисплазия низкой (I и II) степени характеризуется ядерным и клеточным
полиморфизмом, гиперхромией ядер, увеличением в них числа ядрышек, повышением
ядерно-цитоплазматического соотношения, увеличение числа митозов,
незначительными нарушениям цито- и гистоархитектоники желез.
Дисплазия высокой степени (III) отличается появлением большого количества
атипичных клеток с выраженным полиморфизмом и гиперхромией их ядер, увеличением
в них числа ядрышек, повышением ядерно-цитоплазматического соотношения,
увеличением числа митозов (могут встретиться единичные атипичные), цито- и
гистоархитектоники желез с усложнением их строения, образованием
внутрипросветных мостиков и сетчатых структур. В последние годы на смену понятию
"дисплазия" приходит новое - интраэпителиальная неоплазия. Соответственно,
дисплазия слабой и умеренной степени (I и II степени) объединены под термином
интраэпителиальная неоплазия I или низкой степени, а тяжелая дисплазия и рак in
situ - как интраэпителиальная неоплазия II, или высокой степени, тяжелая.
Таблица 1. Характерные признаки дисплазии высокой
и низкой степени
| Дисплазия низкой степени |
Дисплазия высокой степени |
|
Структура крипт |
| Сохранена |
Нарушена, имеются разветвления и боковые каналы, внутрипросветные
мостики и сетчатые структуры |
| |
Железы расположены “спина к спине” |
|
Ядра |
| Увеличены |
Увеличены |
| Гиперхромны |
Гиперхромны |
| Минимально выражены вариабельность размеров и формы (слабо выраженный
полиморфизм) |
Выражены вариабельность размеров и формы (выраженный полиморфизм) |
В случае обнаружения у больного с ПБ при гистологическом исследовании
признаков дисплазии эпителия пищевода необходимо повторное эндоскопическое
исследование для исключения АКП.
Наиболее важным фактором, влияющим на постановку диагноза дисплазии является
практическая установка для патолога. Если патолог ставит диагноз “дисплазия
высокой степени”, то пациент становится кандидатом на внутрипросветное
эндоскопическое лечение или резекцию пищевод. При выявлении дисплазии высокой
степени следует обязательно провести повторное эндоскопическое исследование в
условиях специализированного учреждения с использованием всех доступных
уточняющих эндоскопических методик с прицельной биопсией для исключения АКП.
Манометрия
Исследование двигательной функции пищевода позволяет изучить показатели движения
стенки пищевода и деятельности его сфинктеров. При ПБ
манометрия выявляет снижение давления нижнего пищеводного сфинктера, наличие
грыжи пищеводного отверстия диафрагмы, увеличение количества преходящих
расслаблений сфинктера, снижение амплитуды перистальтических сокращений стенки
пищевода. Манометрия является непременным атрибутом обследования пациента для
решения вопроса о хирургическом лечении[60].
На сегодняшний день на смену традиционной манометрии приходит методика
манометрии высокого разрешения, которая обладает более высокой чувствительностью
в диагностике нарушений двигательной функции пищевода, нижнего пищеводного
сфинктера.
рН-метрическое исследование пищевода
Основным методом диагностики ГЭР – ключевого фактора развития ПБ, служит
суточная рН-метрия пищевода и желудка. При диагностике ГЭР результаты
рН-метрии оценивают по общему времени, в течение которого рН принимает значения
менее 4-х единиц, общему числу рефлюксов за сутки, числу рефлюксов
продолжительностью более 5 минут, длительности наиболее продолжительного
рефлюкса. Суточная рН-метрия имеет очень высокую чувствительность (88-95 %) в
диагностике кислых ГЭР и помогает в индивидуальном подборе лекарственных
препаратов[60].
Однако, традиционная рН метрия пищевода, считавшаяся до недавнего времени
«золотым стандартом» в диагностике ГЭР, имеет ограничения в отношении
обнаружения рефлюксов с рН более 4, когда содержимое желудка, попадающее в
пищевод нейтрализовано пищей, антисекреторными препаратами или щелочным
содержимым двенадцатиперстной кишки [68], что особенно важно для пациентов с ПБ,
в развитии которого большое значение имеют рефлюксы, содержащие желчь и другие
компоненты двенадцатиперстной кишки с щелочной средой.
Суточная рН-импедансометрия пищевода
С помощью измерения импеданса в просвете пищеводе стало возможным
идентифицировать не только кислые, но и слабокислые, слабощелочные и газовые
рефлюксы (отрыжка). В случае сохранения жалоб у пациента проведение
рН-импедансометрии пищевода даже без отмены антисекреторных препаратов позволяет
уточнить адекватность проводимой терапии, оценить эффективность пищеводного
клиренса, решить вопрос о тактике дальнейшего лечения (смена препарата,
увеличение дозы ИПП, отмена антисекреторного препарата и др.). Возможность с
помощью рН-импедансометрии идентифицировать некислые и щелочные рефлюксы делает
этот метод незаменимым для диагностики ГЭР у больных с ПБ.
Значимость нового метода подчеркивают рекомендации
Американской гастроэнтерологической ассоциации за 2008 год, которые указывают на
необходимость использования рН-импедансометрии для диагностики ГЭРБ в неясных
случаях и при применении антисекреторной терапии [69]. Исследования, проведенные
с использованием видеофлюороскопии и сцинтиграфии показали, что импедансометрия
демонстрирует высокую корреляцию с результатами данных методов и может служить
им реальной альтернативой.
Имеющийся на сегодняшний день опыт использования рН-импедансометрии пищевода
позволяет считать данный метод наиболее точным и современным в диагностике ГЭР,
в том числе – и у больных с ПБ. В связи с чем, целесообразно широкое внедрение
рН-импедансометрии в практическую деятельность врачей общей практики и
гастроэнтерологов для оптимизации диагностики и лечения больных с ПБ [68].

