| ГЛАВА VII. ЛЕЧЕНИЕ БРОНХИАЛЬНОЙ АСТМЫ У ДЕТЕЙ |
|
Медицинская библиотека / Раздел "Книги и руководства" / Бронхиальная астма у детей. Стратегия лечения и профилактика / ГЛАВА VII. ЛЕЧЕНИЕ БРОНХИАЛЬНОЙ АСТМЫ У ДЕТЕЙ
Данная информация предназначена для специалистов в области здравоохранения и фармацевтики. Пациенты не должны использовать эту информацию в качестве медицинских советов или рекомендаций.
Cлов в этом тексте - 7292; прочтений - 69881
Размер шрифта:
12px |
16px |
20px
ГЛАВА VII
ЛЕЧЕНИЕ БРОНХИАЛЬНОЙ АСТМЫ У ДЕТЕЙ
7.1. МОНИТОРИРОВАНИЕ ТЕЧЕНИЯ БРОНХИАЛЬНОЙ АСТМЫ У ДЕТЕЙ
КЛЮЧЕВЫЕ ПОЛОЖЕНИЯ:
·1 Астму можно эффективно
контролировать у большинства больных, однако вылечить ее не удается.
·2 Плохая диагностика и
неадекватная терапия - основные причины тяжелого течения и смертности от
астмы.
·3 Выбор лечения должен быть
сделан с учетом тяжести течения и периода бронхиальной астмы. Однако в
любом случае необходим индивидуальный подход в выборе средств и методов
лечения.
·4 При назначении лекарственных
препаратов рекомендуется “ступенчатый” подход, который включает в себя
увеличение количества и частоты приема лекарств по мере возрастания
тяжести течения астмы.
·5 Наиболее эффективным лечением
атопической астмы является элиминация причинно-значимого аллергена,
однако на практике это возможно далеко не всегда.
·6 Наряду с медикаментозными на
практике в комплексной терапии часто используются и немедикаментозные
методы лечения. Эффективность большинства из них не доказана и нуждается
в дальнейшем изучении.
& невозможно без установления партнерских, доверительных отношений между
врачом, больным ребенком, его родителями и близкими.
Постоянное наблюдение за детьми, больными бронхиальной астмой, дает возможность
контролировать течение заболевания, эффективность проводимой терапии, вносить
соответствующие лечебные коррективы.
Оценка течения бронхиальной астмы
у детей проводится при посещении врача, на основании анкетного опроса больных,
характера клинических проявлений и исследования функционального состояния
внешнего дыхания.
Анкетный опрос осуществляется по специально составленной форме, заполняемой
больным ребенком (родителями), с оценкой состояния ребенка, динамикой и
качеством симптомов заболевания, наличием сопутствующих заболеваний, частоты
применения и эффективности лекарственных препаратов. Больные дети и их родители
должны быть хорошо информированы о течении заболевания и признаках болезни,
уметь распознавать обострение заболевания, оценивать выраженность
соответствующих симптомов (кашель, одышка, свистящие хрипы, характер сна и др.),
анализировать влияние факторов окружающей среды на течение заболевания.
Оценка тяжести течения заболевания ведется врачом на основании учета тяжести
и частоты обострений бронхиальной астмы, состояния ребенка в межприступном
периоде, объема оптимальной терапии, приносящей эффект.
До 5 лет оценка и мониторинг тяжести астмы с анализом показателей внешнего
дыхания, включая PEF, невозможны. Поэтому определение тяжести астмы у
большинства детей должно основываться на клинических критериях, результатах
анкетирования, данных дневника.
Измерение PEF у детей школьного возраста в поликлинике, стационарах, домашних
условиях служит объективным параметром для оценки степени бронхиальной
обструкции и составления лечебных рекомендаций. Техника пикфлоуметрии,
правильность интерпретации полученных данных и адекватность реагирования на
изменение показателей должны контролироваться врачом и родителями. Результаты
пикфлоуметрии заносят в дневник самонаблюдения.
Измерение газов артериальной крови может обеспечить важный контроль при
оценке тяжести обострения астмы. Измерение сатурации кислорода (пульсовая
оксиметрия) должна проводиться в отделениях интенсивной терапии: при этом нижний
уровень значения О2 не должен быть менее 95%.
Рис. 7-1 Вариант дневника пациента
Дата
| PEF |
Заложенность носа |
Кашель |
Свистящее дыхание |
Потребность в
бронхолитиках |
Базисная терапия |
| |
утро вечер |
день ночь |
день ночь |
день ночь |
|
|
| |
|
|
|
|
|
|
| |
|
|
|
|
|
|
Примечание: “-” -
отсутствие симптома.. “+” - симптом выражен слабо. “++” - симптом выражен
значительно. “+++” - максимальное проявление симптома для данного больного.
Если больной получал ингаляцию бронхолитического препарата, отметьте в
дневнике PEF в течение первых 4-х часов после приема лекарственного
средства. |
Рис. 7-2 Должные значения PEF (л/мин )*
| |
Возраст (лет) |
|
Рост |
Мальчики |
Девочки |
|
(см) |
5-14 |
15 |
5-14 |
15 |
|
100 |
24 |
|
39 |
|
|
105 |
51 |
|
65 |
|
|
110 |
77 |
|
92 |
|
|
115 |
104 |
|
118 |
|
|
120 |
130 |
|
145 |
|
|
125 |
156 |
|
171 |
|
|
130 |
183 |
|
197 |
|
|
135 |
209 |
|
224 |
|
|
140 |
236 |
414 |
250 |
348 |
|
145 |
262 |
423 |
276 |
355 |
|
150 |
289 |
432 |
303 |
360 |
|
155 |
440 |
329 |
366 |
366 |
|
160 |
488 |
356 |
371 |
371 |
|
165 |
368 |
456 |
382 |
376 |
|
170 |
394 |
463 |
408 |
381 |
|
175 |
421 |
469 |
435 |
385 |
|
180 |
|
479 |
|
390 |
|
185 |
|
482 |
|
394 |
|
190 |
|
488 |
|
398 |
| * (По
Godfrey S.,Kamburoff Pl., Nairn J.R. Spirometry,lung volumes and airway
resistance in normal children aged 5 to 18 years. Brit.J.Dis.Chest, 1970;
64:15). |
7.2.ФУНКЦИОНАЛЬНАЯ ОЦЕНКА И МОНИТОРИРОВАНИЕ ТЯЖЕСТИ
БРОНХИАЛЬНОЙ АСТМЫ
Для оценки тяжести течения бронхиальной астмы, наряду с клиническими
симптомами, рекомендуется опираться на результаты спирографического измерения
объема форсированного выдоха за 1 сек (FEV1) и измерения пикового экспираторного
потока ( PEF) с помощью пикфлоуметра.
При бронхиальной астме легкого течения величины FEV1 и PEF не изменяются, их
значения выше 80% от должного, а суточные колебания PEF составляют менее 20 %. (Исследования
следует проводить до приема лекарств.).
Умеренная по тяжести бронхиальная астма сопровождается снижением FEV1 и PEF в
пределах 60-80% от должного значения. Суточные колебания показателя PEF
составляют 20-30% и показатель PEF обычно нормализуется после приема
бронходилататора.
Тяжелая бронхиальная астма характеризуется значительным снижением показателей
FEV1 и PEF (менее 60% от должного значения),суточный разброс значений PEF
превышает 30% и оптимальная терапия не возвращает показатель к норме.
Для мониторинга бронхиальной астмы в домашних условиях у детей старше 5-6 лет
рекомендуется использовать пикфлоуметрию ежедневное измерение максимальной
скорости выдоха. Объективный контроль за функцией легких очень важен как для
куратора, так и для пациента, он позволяет оценить течение болезни,
контролировать эффективность лечения и при необходимости своевременно проводить
его коррекцию.
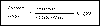
В педиатрии мониторинг бронхиальной астмы с помощью пикфлоуметрии еще не
получил широкого признания. Одной из основных задач педиатра является донесение
до родителей ребенка, страдающего бронхиальной астмой, а в случаях с подростками
до сознания самого ребенка важности динамического исследования функционального
состояния легких.
Нормальные значения максимального потока выдоха зависят от возраста пациента,
его физического развития и обычно приложены в виде таблицы к пикфлуометру.
Приводимые в литературе должные значения пикового экспираторного потока
различаются. Приводим показатели PEF по Godfrey et al.(1970).
Целесообразно в период, когда пациент чувствует себя хорошо, при отсутствии
клинических признаков обструкции провести исследование функции легких с помощью
спирометрии или исследования кривой поток-объем форсированной жизненной емкости
легких. Параллельно с этим исследованием необходимо провести пикфлоуметрию на
приборе, которым будет пользоваться пациент. Тест выполняется в положении стоя.
Ребенку необходимо объяснить, что он должен набрать в легкие как можно больше
воздуха , а затем выдохнуть этот воздух максимально быстро. Форсированный выдох
выполняется трижды и максимальное значение выбирается в качестве исходного, с
которым сравниваются все дальнейшие измерения как при мониторировании функции
дыхания в домашних условиях, так и при последующих визитах к врачу. Увеличение
числа попыток до 5 незначительно увеличивает величину PEF.
Объективную информацию о функции легких у детей можно получить начиная с
5-летнего возраста. Врач должен научить технике правильного выполнения
дыхательного маневра PEF с тем, чтобы в дальнейшем избежать ошибочной оценки
неправильно выполненного теста. Наблюдения за мониторированием PEF в домашних
условиях с помощью электронного пикфлоуметра показали, что даже взрослые
пациенты, страдающие бронхиальной астмой, часто не соблюдают часы, кратность и
регулярность измерения PEF.
Как известно, измерения PEF проводят утром и вечером, а в случаях приема
бронходилатирующих препаратов до и после их применения. Своевременное измерение
PEF важно по той причине, что ежедневно должна проводиться оценка изменчивости
показателя, которая позволяет контролировать течение бронхиальной астмы. Эта
изменчивость может быть рассчитана по формуле:
Если пациент использует бронходилатирующее средство, то учитывается разница
между утренним значением до приема препарата и вечерним измерением PEF после
приема лекарства.
Эффективность мониторирования PEF в домашних условиях зависит от нескольких
факторов. Важно соблюдать часы утреннего и вечернего выполнения теста.
Полученные результаты обязательно должны регистрироваться. Обычно к
пикфлоуметрам прилагаются схемы или дневники регистрации полученных данных. Если
ребенок дома получает лечение (бронходилататоры) постоянно или родители в силу
обстоятельств вынуждены прибегнуть к их использованию, исследование PEF должно
быть выполнено до и после приема лекарства, и это необходимо отразить в дневнике.
Важным является знание родителями тех обстоятельств, когда следует обратиться за
врачебной помощью до оговоренной даты следующего посещения (при суточном
колебании PEF свыше 20%).
Для того, чтобы помочь пациенту контролировать течение бронхиальной астмы,
были разработаны специальные зоны (зеленая, желтая, красная).В соответствии с
этими зонами врач устанавливает нижние границы значения PEF, равные 80 и 60% от
должного значения PEF (или от лучшего результата, полученого у ребенка вне
периода обострения).
Зеленая зона показатель нормы астма под контролем. Физическая активность и
сон не нарушены, симптомы болезни минимальны или отсутствуют. PEF > 80% должных
или лучших индивидуальных показателей. Суточный разброс показателей не превышает
20%. Терапия определяется тяжестью течения астмы. При сохранении стабильного
состояния в течение не менее 3 мес. может ставиться вопрос об отмене или
уменьшении объема терапии.
Желтая зона сигнал Внимание. Появляются клинические симптомы астмы в виде
кашля, свистящих хрипов, одышки (особенно ночью), тяжести в груди. Снижается
активность, нарушается сон. PEF - 60-80% от должных или лучших индивидуальных
значений с суточным разбросом 20-30%. Переход в желтую зону указывает на
начинающееся или развившееся обострение. Необходим прием препаратов в
соответствии с назначениями врача при этой клинической ситуации, при
необходимости усиление базисной терапии.
Красная зона сигнал тревоги. Симптомы астмы присутствуют в покое и при
нагрузке. Отмечаются кашель, одышка с участием в дыхании вспомогательной
мускулатуры. Значение PEF < 60% от должных или лучших индивидуальных значений с
суточным разбросом более 30%. Необходим прием препаратов для экстренной помощи (согласно
рекомендованному врачом плану), незамедлительное обращение за медицинской
помощью. Переход в красную зону свидетельствует о необходимости пересмотра плана
медикаментозной терапии в зеленой зоне.
7.3. БАЗИСНАЯ ТЕРАПИЯ БРОНХИАЛЬНОЙ АСТМЫ У ДЕТЕЙ
Существенный прогресс в лечении бронхиальной астмы был достигнут при
выделении базисной терапии, призванной воздействовать на воспалительный процесс.
К этим методам относится ингаляционное назначение кромогликата или недокромила
натрия и кортикостероидных препаратов, специфическая вакцинация аллергенами (иммунотерапия).
Основу терапии бронхиальной астмы у детей составляет противовоспалительная
терапия. В случаях обострения бронхиальной астмы осуществляется подключение
бронхоспазмолитических средств. Характер проводимого противорецидивного лечения
определяется тяжестью бронхиальной астмы, возрастом больных детей, динамикой
состояния больного на фоне начатой превентивной терапии.
Детям с легкой и среднетяжелой бронхиальной астмой противовоспалительная
терапия проводится с использованием таких нестероидных противовоспалительных
средств, как кромогликат или недокромил натрия, при тяжелом течении бронхиальной
астмы необходимо использование ингаляционных кортикостероидов. Одна из причин
распространенной фобии при назначении гормональных препаратов обусловлена
бесконтрольным назначением препаратов системного действия, применение которых
весьма ограничено. Ингаляционные кортикостероиды имеют существенные преимущества
перед системными.
Одновременно с проведением базисной терапии у больных бронхиальной астмой
детей осуществляется лечение других, сопутствующих основному заболеванию
патологических процессов. Осуществление наблюдения за состоянием больного и
мониторинга проводимого лечения с исследованием функции внешнего дыхания
позволяет в случае необходимости своевременно провести коррекцию назначенной
терапии.
Кромогликат натрия и недокромил натрия занимают основное место в лечении
легкой и среднетяжелой астмы у детей и менее эффективны при тяжелом ее течении.
Широкий спектр активности препаратов этого класса определяется способностью
ингибировать как раннюю фазу аллергического ответа, так и позднюю фазу
аллергических реакций при хроническом воспалении и уменьшать бронхиальную
гиперреактивность.
Кромогликат натрия принадлежит к широко используемым фармакологическим
средствам лечения бронхиальной астмы у детей. Необходим курс не менее 1,5-2
месяцев по 1-2 ингаляции 3-4 раза в день. Нежелание пациентов и врача ждать в
течение этого периода является одной из главных причин, почему антиаллергические
препараты рассматриваются как неэффективные. Детям раннего возраста возможны
ингаляции раствора препарата с помощью небулайзера масочным способом. При
сохраняющихся приступах или бронхообструкции, по данным спирографии, эффективным
может быть назначение комбинированных препаратов, в состав которых, помимо
кромогликата натрия, входят симпатомиметики. Применение кромогликата натрия
способствует урежению и более легкому течению приступов бронхиальной астмы,
исчезновению ночных приступов, препарат предупреждает возникновение приступов
бронхиальной астмы при физическом напряжении. Длительное применение препарата
позволяет поддерживать устойчивую ремиссию болезни.
Недокромил натрия представляется более специфичным для лечения воспаления
бронхов при астме, тормозит высвобождение медиаторов аллергии. Он ингибирует
высвобождение из воспалительных клеток слизистой оболочки дыхательных путей
LTC4, PGD2, PAF, хемотаксических факторов.
В исследованиях in vitro показана ингибиция аккумуляции эозинофилов в легких
после провокаций аллергенами, причем недокромил натрия обладает приблизительно в
6-8 раз большей активностью, чем кромогликат натрия. In vivo кромогликат и
недокромил натрия уменьшают активацию эозинофилов, нейтрофилов и макрофагов.
Недокромил натрия предотвращает бронхоконстрикцию, вызванную аллергеном,
физическими упражнениями, холодным воздухом, диоксидом серы.
Продолжительное, не менее 2 месяцев, назначение ингаляций недокромила натрия
(по 2 ингаляции 2 раза в день) способствует снижению бронхиальной
гиперреактивности, урежению приступов бронхиальной астмы, более легкому их
течению и достижению клинической ремиссии болезни. Этот препарат очень широко
применяется для лечения астмы у детей. Наряду с дозированным ингалятором
применяются ингаляторы со спейсером. У детей с астмой использование только
кромогликата или недокромила натрия может обеспечить терапию астмы без
потенциальных опасностей, которые отмечаются при применении
b2-адреномиметиков,
кортикостероидов или теофиллинов. Поэтому эти препараты особенно полезны у детей
на начальных этапах заболевания.
Ингаляционные кортикостероиды (ИКС). Воспалительный процесс в бронхах
выявляется не только во время обострения, но и в фазе ремиссии, в связи с чем
необходимым является длительное применение противовоспалительных препаратов для
профилактики обострений бронхиальной астмы. Наиболее мощным
противовоспалительным эффектом обладают кортикостероиды, которые применяются как
короткими курсами при лечении обострений, так и длительно при непрерывно
рецидивирующем течении астмы.
В клинической практике наиболее показательным при лечении ИКС является
улучшение легочной функции. Другие положительные эффекты включают уменьшение
вариабельности показателей ФВД в течение дня, а также потребности в
кортикостероидах per os, защиту от бронхоконстрикции при контакте с антигеном,
при длительном применении снижение частоты обострений и частоты госпитализаций.
Предполагается влияние ингаляционных кортикостероидов на снижение смертности от
астмы, предотвращение изменений в легких, ведущих к необратимой обструкции
дыхательных путей.
Современные ингаляционные кортикостероиды (беклометазон, будезонид,
флунисолид, флутиказон) оказывают минимальное общее воздействие. Результаты
исследований свидетельствуют о необходимости длительного применения
ингаляционных кортикостероидов при тяжелом течении (не менее 6-8 месяцев),
однако даже при длительной ремиссии после отмены препарата возможно
возобновление симптомов заболевания. Ингаляционные кортикостероиды назначают
после ликвидации основных симптомов острой дыхательной недостаточности,
восстановления бронхиальной проходимости. Ингаляционные кортикостероиды имеют
относительно медленное начало действия через несколько дней, поэтому возможна
комбинация в начале лечения с парентеральным или энтеральным введением
кортикостероидов и бронхолитиков (пролонгированными теофиллинами и
симпатомиметиками).
При кратковременном назначении ингаляционные кортикостероиды не имеют
очевидных побочных эффектов. Менее чем у 5% пациентов отмечается оральный
кандидоз, несколько чаще описана дисфония (20-30%). Длительное назначение
нередко ограничивается опасением побочных эффектов в виде системного воздействия
на организм.
В настоящее время не получено клинически достоверных данных депрессивного
влияния ИКС на гипоталамо-гипофизарно-надпочечниковую систему у детей,которым
проводят эту терапию в течение нескольких лет при использовании стандартных (в
педиатрии) доз.
Нет доказательств увеличения риска катаракт у детей, частоты инфекций,
включая туберкулез, при лечении ИКС. У маленьких детей, лечившихся
небулизированными кортикостероидами, может наблюдаться истончение кожи вокруг
рта.
Бронхорасширяющая терапия для длительного применения.
При недостаточном эффекте базисной противовоспалительной терапии в комплекс
терапии добавляют пролонгированные бронхолитики (теофиллины длительного действия
или пролонгированные b2-агонисты).
Теофиллины длительного действия используют как в комплексе
противовоспалительной терапии, так и для предупреждения возникновения приступов
бронхиальной астмы, особенно ночных.
Рис. 7-3 Суточные дозы ингаляционных стероидов для детей
| |
Средние дозы |
Высокие дозы |
| Беклометазон |
400-600 мкг* |
> 600 мкг |
| Будезонид |
200-400 мкг |
> 400 мкг |
| Флунисолид |
500-1000 мкг |
> 1000 мкг |
| Флутиказон |
200-400 мкг* |
> 400 мкг |
| Триамцинолона
ацетонид |
800-1000 мкг |
> 1000 мкг |
| *- У детей раннего
возраста доза беклометазона составляет 200 - 300 мкг/сут, флутиказона - 100
- 200 мкг/сут. |
Оптимальной является доза теофиллина, обеспечивающая в сыворотке
концентрацию, равную 8-15 мкг/мл. Суточная доза пролонгированных теофиллинов
составляет 12-15 мг/кг массы тела, для больных с тяжелым течением бронхиальной
астмы она несколько ниже (11-12 мг/кг массы тела).
Рис. 7-4 Основные препараты группы
b2-агонистов
|
Международное название |
Суточная доза |
| b2-агонисты
короткого действия |
| Сальбутамол |
400 мкг |
| Тербуталин |
1000 мкг |
| Фенотерол |
400 мкг |
| b2-агонисты
длительного действия |
| Сальметерол |
100 мкг |
| Формотерол |
24 мкг |
Ингаляционные b2-агонисты
длительного действия (сальметерол,
формотерол) обеспечивают
бронходилатирующий эффект на протяжении 12 часов. Пролонгированные b2-агонисты
обычно назначают больным при наличии признаков недостаточной эффективности
проводимой противовоспалительной терапии. Их можно использовать в целях
сокращения числа возникающих приступов бронхиальной астмы и, в частности, для
предупреждения приступов, возникающих в вечерние и ночные часы. Пероральные
формы b2-агонистов
длительного действия (например, вольмакс, спиропент) в основном используются при
нетяжелом течении бронхиальной астмы.
Другая медикаментозная терапия.
Антилейкотриеновые препараты. В связи с доказанной ролью лейкотриенов
в формировании наиболее важных патогенетических звеньев бронхиальной астмы
возможно применение у детей с легкой и средней тяжести астмой стало применение
антилейкотриеновых препаратов, которые представлены следующими двумя группами
соединений: ингибиторы синтеза (зилетон) и блокаторы рецепторов к лейкотриенам (зафирлукаст,
монтелукаст).
Кетотифен находит применение в лечении легкой и среднетяжелой
бронхиальной астмы у детей, особенно у детей раннего возраста при сочетании
бронхиальной астмы с кожной и/или гастроинтестинальной аллергией.
Противоаллергический иммуноглобулин, гистаглобулин. В настоящее время
не рекомендуются большинством руководств в качестве стандартного метода терапии
БА.
Иммуностимуляторы бактериального происхождения (IRS-19, бронхо-мунал,
бронховакс, рибомунил и др.). Применение иммуностимулирующих бактериальных
препаратов снижает частоту интеркуррентных острых респираторных заболеваний и
обострений очагов хронической инфекции и тем самым способствует урежению
обострений бронхиальной астмы. Не входят в число стандартных методов базисной
терапии.
Специфическая аллерговакцинация.
Термин специфическая вакцинация аллергенами (specific allergy vaccination)
рекомендуется рабочей группой ВОЗ по Иммунотерапии аллергенами в Женеве 1997 г.,
вместо терминов гипосенсибилизация или иммунотерапия. Этот патогенетически
обоснованный метод лечения атопической бронхиальной астмы, поллиноза,
аллергического риносинусита и конъюнктивита заключается во введении больному
нарастающих доз одного или нескольких причинно-значимых аллергенов.
При бронхиальной астме у детей специфическая иммунотерапия проводится
аллергенами домашней пыли, Dermatophagoides pteronyssimus, Dermatophagoides
farinae, пыльцевыми, эпидермальными и грибковыми аллергенами. Проведение
специфической иммунотерапии показано детям с атопической бронхиальной астмой
легкого и среднетяжелого течения, при четкой доказанности причинной значимости
аллергенов, в случаях малой эффективности проводимой фармакотерапии и
невозможности элиминировать причинно-значимые аллергены из окружающей больного
среды.
Для проведения специфической иммунотерапии, помимо
общепринятого парентерального апробируются эндоназальный, пероральный,
сублингвальный пути введения лечебных аллергенов. Продолжительность
специфической иммунотерапии составляет 3-4 года, более эффективна она в случаях
бронхиальной астмы, обусловленной моновалентной (особенно пыльцевой)
сенсибилизацией.
Проведение специфической гипосенсибилизации требует использования
стандартизованных экстрактов аллергенов тщательного мониторного контроля в ходе
лечения и квалификации специалиста.
7.4. ПРЕПАРАТЫ ДЛЯ ОКАЗАНИЯ ЭКСТРЕННОЙ ПОМОЩИ
Для снятия у больных бронхиальной астмой остро возникших нарушений
бронхиальной проходимости используют b2-агонисты
короткого действия, антихолинергические препараты, теофиллины короткого действия.
Предпочтение, по возможности, следует отдать ингаляционным формам введения
препаратов, позволяющим получить быстрый эффект и уменьшить общее воздействие на
организм ребенка (не распространяется на теофиллин).
b2-агонисты
короткого действия (сальбутамол, тербуталин, фенотерол)
при их ингаляционном применении дают быстрый, через 5-10 минут,
бронходилатирующий эффект. Препараты этого ряда могут использоваться для
купирования приступов бронхиальной астмы, для профилактики приступов удушья,
связанных с физическим напряжением. Ингаляционные
b2-агонисты
короткого действия назначаются не более 4-х раз в день. С целью стабилизации
состояния больных могут проводиться короткие, до 7-10 дней, курсы лечения. При
нетяжелых приступах бронхиальной астмы можно использовать пероральные формы
b2-агонистов
(сальбутамол, вентолин). Предпочтение отдается эпизодическому назначению. При
увеличении частоты использования b2-агонистов
более 3-4 раз в сутки необходим пересмотр и усиление базисной терапии. При
длительном бесконтрольном применении b2-агонистов
возможно усиление признаков бронхиальной гиперреактивности.
Теофиллины короткого действия. При легких приступах бронхиальной астмы
назначение эуфиллина перорально может быть использовано для купирования
возникших нарушений бронхиальной проходимости. В большинстве случаев он
используется у больных бронхиальной астмой после купирования приступа
затрудненного дыхания ингаляционными b2-агонистами
для полного восстановления бронхиальной проходимости. Применяемая парентерально
средняя терапевтическая суточная доза эуфиллина: у детей 3-14 лет составляет
10-15 мг/кг массы тела, а в возрасте до 3-х лет 5-10 мг/кг массы тела. При
приеме эуфиллина внутрь максимальная концентрация в плазме достигается примерно
через 1 час. Период полувыведения 4-5 часов. Поэтому подобный путь введения
целесообразно использовать при легких и умеренных приступах удушья. У больных с
тяжелым приступом бронхиальной астмы, резистентных к терапии
b2-агонистами,
и при астматическом состоянии инфузионная терапия эуфиллином является одним из
основных компонентов в комплексе проводимых лечебных мероприятий. Проводить ее
необходимо в условиях стационара, что связано с высокой частотой токсических
эффектов.
Антихолинергические препараты. Ингаляционные антихолинергические препараты (ипратропиум
бромид, окситропиум бромид) могут использоваться для купирования приступов
бронхиальной астмы. Максимум бронходилатирующего эффекта развивается через 30
мин. после ингаляции. У детей с первых месяцев жизни возможно использование
ипратропиума бромида через небулайзер. Сочетание с b2-агонистами
(беродуал) обеспечивает синергический эффект. Наиболее эффективны ингаляционные
антихолинергические препараты в случаях приступов, возникающих на фоне острой
респираторной вирусной инфекции, при воздействии ирритантов.
Лечение тяжелого приступа бронхиальной астмы
Терапия, проводимая при тяжелом приступе бронхиальной астмы, включает
мероприятия, направленные на устранение бронхоспазма, уменьшение вазосекреторных
расстройств, разжижение и удаление мокроты, ликвидацию дыхательной и сердечной
недостаточности, гипоксии, метаболических нарушений и надпочечниковой
недостаточности.
Оксигенотерапия начинается с момента поступления проводится для
поддержания адекватного уровня SаО2 (у детей более 95%). Кислород
подается при помощи носовых канюль, маски или кислородной палатки.
Регидратационная терапия необходима при развитии дегидрации
вследствие увеличения частоты дыхания и уменьшения приема жидкости.
В качестве базисных растворов при проведении инфузионной терапии используется
изотонический раствор натрия хлорида и 5%-ный раствор глюкозы (взятых поровну).
Количество внутривенно вводимой жидкости у детей раннего возраста , в
зависимости от варианта приступного периода, составляет 20-10 мл/кг массы, а
общий объем 150-300 мл; скорость введения 12-14 капель/мин, длительность инфузии
(в зависимости от объема) 3-6 часов.
b2-агонисты
короткого действия
являются основными начальными
средствами купирования приступов удушья. Селективные
b2-адреномиметики (сальбутамол,
тербуталин, фенотерол) обеспечивают наиболее быстрое и
выраженное расширение бронхов при минимальных побочных эффектах. Начальное
лечение предусматривает подачу одной ингаляционной дозы каждые 20 минут в
течение одного часа. Эффект при использовании дозированных аэрозольных
ингаляторов развивается через 5-10 минут, длительность действия составляет 4-6
часов.
Ребенок с тяжелым приступом астмы имеет ограниченную способность к ингаляции.
Поэтому введение
b2-агонистов
должно осуществляться через небулайзер или спейсер.
При недостаточной эффективности ингаляционных b2-адреномиметиков
в течение 1 часа дополнительно может быть использовано парентеральное введение
тербуталина, орципреналина, или (при отсутствии видимого улучшения) адреналина (эпинефрина).
Действие адреналина, введенного подкожно или внутримышечно (в малых и средних
дозах), начинается через 15-20 минут и длится 1-2 часа.
Усиление бронхолитического действия b2-адреномиметиков
может быть достигнуто и при комбинации с ингаляционными (через небулайзер)
антихолинергическими средствами (ипратропиум бромид 0,25 мг, детям первого года
жизни 0,125 мг), или пероральным приемом эуфиллина.
Бесконтрольное применение этих средств или неправильная их дозировка могут
сопровождаться выраженными побочными явлениями: тахикардией, экстрасистолией,
артериальной гипертензией, головокружением, бессонницей, беспокойством,
гиперестезией, тремором рук.
Необходимо также учитывать возможность появления феномена десенситизации
b2-адренорецепторов
бронхов (тахифилаксии) при длительном и бесконтрольном применении
адреностимуляторов. При астматическом состоянии, когда имеется блокада
b2-адренорецепторов,
возникшая при многократном использовании симпатомиметиков, указанные препараты
не должны использоваться. Их применение в этих случаях может привести к
ухудшению состояния и даже летальным исходам. Неэффективность введенного
адреналина или наличие клинических признаков блокады b2-адренорецепторов
диктует необходимость парентерального использования эуфиллина, кортикостероидов.
Теофиллины короткого действия (теофиллин, эуфиллин) широко
применяется при лечении больных, в том числе с наиболее тяжелыми и опасными для
жизни проявлениями бронхиальной астмы (тяжелый приступ удушья, астматические
состояния, асфиксический синдром).
Нагрузочная доза составляет 4,5-5 мг/кг в течение 20-30 мин. В последующем
эуфиллин может вводиться в виде непрерывной инфузии в дозе 0,6-1 мг/кг/ч или
дробно в соответствующих дозах через каждые 4-5 часов под контролем концентрации
теофиллина в крови, так как терапевтическая его концентрация колеблется в
пределах 10-15 мкг/мл.
Побочные эффекты препаратов ксантинового ряда (тошнота, рвота, тахикардия,
аритмия, артериальная гипотония, гиперестезия, судороги, остановка сердца)
наблюдаются при передозировке препаратов.
Нельзя использовать пролонгированные препараты теофиллина (теотард,
теопек, ретафил, эуфилонг, теодур и др.) в терапии острых приступов бронхиальной
астмы!
Кортикостероидные гормоны занимают важнейшее место в
лечении тяжелой бронхиальной астмы.
Основные показания для назначения системных кортикостероидов наличие
резистентности к терапии b2-агонистами
и другими бронхоспазмолитиками, развитие у больных выраженных признаков
дыхательной недостаточности. Системные кортикостероиды могут вводиться каждые
4-6 часов парентерально (внутримышечно или внутривенно) до выведения из приступа
или астматического состояния. Альтернативный вариант лечения состоит в
проведении 5-7 - дневного курса пероральной терапии системными кортикостероидами.
Препаратом выбора при купировании тяжелых астматических кризов является
преднизолон.
Применение кортикостероидов при астматическом состоянии следует начинать на
раннем этапе лечения ввиду их отсроченного действия (в среднем 6 часов).
При лечении острого, тяжелого приступа астмы преднизолон может быть назначен
внутрь в дозе: детям до 1 года 2 мг/кг/сут, 1 - 5 лет 20 мг/сут, старше 5 лет
20-60 мг/сут однократно или коротким курсом 3-7 дней.
До стабилизации состояния доза препарата распределяется
равномерно в течение суток, в дальнейшем с учетом циркадного ритма функции коры
надпочечников. При достижении полной клинической ремиссии постепенную отмену
преднизолона начинают с уменьшения вечерней дозы, добавления ингаляционных
кортикостероидов и постепенного перевода на терапию ИКС. Следует помнить, что
форсированное уменьшение дозы кортикостероидов или полная их отмена без учета
состояния ребенка является одной из основных причин развития асфиксического
синдрома.
Другие виды лечения
В исключительных случаях при отсутствии эффекта от терапии может
возникнуть необходимость применения поднаркозной бронхоскопии.
При наличии инфекционно-воспалительных изменений в бронхолегочной системе
назначается антибиотикотерапия по общим принципам.
Назначение ингаляционных муколитических препаратов в период тяжелых
обострений бронхиальной астмы может усилить кашель и обструкцию дыхательных
путей.
Следует избегать назначения седативной терапии при обострении астмы,
поскольку бензодиазепины и снотворные препараты угнетают дыхание.
В педиатрической практике, по возможности, следует отдавать предпочтение
неинвазивным процедурам, чтобы не причинять боль и не вызывать у ребенка тревогу.
Возникновение тяжелого обострения указывает на необходимость
пересмотра текущего и перспективного планов медикаментозного лечения.
Показания для госпитализации детей, больных бронхиальной
астмой
При обострении бронхиальной астмы у детей направление на стационарное
лечение показано при следующих ситуациях:
- невозможность или неэффективность (в течение 1-3 часов) проведения
лечения в домашних условиях;
- выраженная тяжесть состояния больного;
- детям из группы высокого риска осложнений и по социальным показаниям;
- при необходимости установления природы и подбора средств терапии
впервые возникших приступов удушья.
Рис. 7-5

7.5. СТУПЕНЧАТЫЙ ПОДХОД К ТЕРАПИИ БРОНХИАЛЬНОЙ АСТМЫ У ДЕТЕЙ
Противорецидивная терапия при бронхиальной астме у детей направлена на
достижение и поддержание устойчивой ремиссии, при этом ее тактика определяется
тяжестью течения болезни. Основу противорецидивного лечения составляет
противовоспалительная терапия.
У детей с легким течением бронхиальной астмы противорецидивная терапия
проводится кромогликатом или недокромилом натрия. В случае возникновения
приступов бронхиальной астмы назначают эпизодически ингаляционные
b2-агонисты.
У больных с неустойчивым по бронхиальной астме состоянием эффективным может
оказаться временное использование комбинированных препаратов (интал плюс, дитэк)
с последующим переходом на терапию кромогликатом или недокромилом натрия.
У детей с бронхиальной астмой среднетяжелого течения лечение начинают с
назначения кромогликата или недокромила натрия и подключения, в случае
возникновения приступа, b2-агонистов.
В случаях возникновения ночных приступов бронхиальной астмы проводимая терапия
может быть дополнена назначением пролонгированных теофиллинов или
симпатомиметиков. В случаях, когда проводимая таким образом терапия оказывается
неэффективной, присоединяют лечение ингаляционными кортикостероидами (беклометазон
в суточной дозе до 400-600 мкг или другие ингаляционные кортикостероиды в
эквивалентных дозах).
У детей с тяжелым течением бронхиальной астмы комплекс терапевтических
мероприятий включает ингаляционные кортикостероиды (в высоких дозах), нередко в
комбинации с ингаляционными пролонгированными b2-агонистами
или препаратами теофиллина длительного действия, антихолинергическими
препаратами. Перорально кортикостероиды назначают в случае неэффективности
ингаляционных форм. В течение 5-7 дней назначают преднизолон в суточной дозе 1-2
мг/кг, затем проводится снижение дозы преднизолона и постепенная его отмена с
переходом на ИКС.
При стабилизации состояния больных доза ингаляционных кортикостероидов у
детей может быть уменьшена, а при наличии устойчивой ремиссии в течение 6-12 мес.
они могут быть полностью отменены. В этом случае больного переводят на терапию
меньшей ступени, т.е.назначают кромогликат или недокромил натрия. Больным с
тяжелым или среднетяжелым течением бронхиальной астмы в случае нестабильности
состояния могут проводиться повторные курсы или непрерывное лечение
ингаляционными кортикостероидами.
Контроль за течением и профилактика обострений пыльцевой бронхиальной астмы в
период цветения причинно-значимых растений осуществляется назначением
кромогликата или недокромила натрия, а также проведением антимедиаторной терапии
(например, кетотифен). При этом терапию назначают за 2-3 недели до
предполагаемого обострения.
В период ремиссии бронхиальной астмы детям с легким и среднетяжелым ее
течением при наличии показаний и условий проводится специфическая вакцинация
аллергенами, позволяющая достичь устойчивой и длительной ремиссии болезни (рис.
7-6).
Особенности лечения детей раннего возраста
Бронхиальная астма у детей до 1 года встречается чаще, чем диагностируется.
У многих больных раннего возраста возникновению астмы предшествует атопический
дерматит. Достижению ремиссии болезни у детей первых лет жизни, страдающих
бронхиальной астмой, способствует соблюдение гипоаллергенного режима, лечение
кетотифеном, ингаляционная терапия раствором кромогликата натрия, недокромила
натрия после 2 лет масочным способом. В случаях обострения бронхиальной астмы
используют b2-агонисты,
доставляемые с помощью дозированного аэрозоля через спейсер, с использованием
лицевой маски или распылителя, антихолинергические препараты, метилксантины.
В случаях тяжелого течения бронхиальной астмы у детей раннего
возраста достичь ремиссии болезни помогает лечение ингаляционными
кортикостероидами с помощью дозированного аэрозоля через спейсер. В качестве
распыляемого кортикостероида у детей раннего возраста может использоваться
беклометазон, флутиказон.
7.6. ИНГАЛЯЦИОННАЯ ТЕХНИКА У ДЕТЕЙ*
Аэрозольное лечение широко используется в современной терапии бронхиальной
астмы у детей, что определяется быстрой доставкой препарата в дыхательные пути,
местной активностью, уменьшением системных побочных эффектов. Практически
большинство бронхолитиков, ингаляционных кортикостероидов, кромогликат и
недокромил натрия попадают в организм ребенка с помощью ингаляции. Обучение
детей с бронхиальной астмой и их родителей правильной технике использования
ингаляционных препаратов исключительно важно.
Наиболее широкое распространение получили дозирующие баллонные ингаляторы, из
которых препарат подается под давлением. Около 30% взрослых и 70-70% детей имеют
трудности при использовании препаратов в этих формах. Плохая ингаляционная
техника оказывает влияние на дозу, попадающую в легкие, и, следовательно, на
ответную реакцию. При наличии трудностей в использовании ингаляторов лекарство
не приносит улучшения или облегчения, что приводит к прекращению приема
препарата.
При использовании дозированного ингалятора требуется синхронизация между
нажатием на баллончик, который выбрасывает аэрозоль, и вдохом ребенка.
Технические ошибки, наблюдаемые в ингаляционной технике, включают нажатие
баллончика перед вдохом, в конце вдоха, во время выдоха, множественные нажатия
во время ингаляции, отсутствие задержки дыхания в конце ингаляции, недостаточное
встряхивание баллончика и т.д.
При недостаточной координации меньшее количество препарата может поступать в
легкие, однако в этом случае при лечении ингаляционными кортикостероидами
побочный эффект может возрастать вследствие большего попадания лекарства в
полость рта и глотки.
Важный момент в ингаляции из дозированного ингалятора задержка дыхания в
конце вдоха. Эта пауза дает дополнительное время осаждению частиц на поверхности
дыхательных путей.
У детей возможно применение ингаляции с широко открытым ртом наряду с обычной
техникой, т.е. когда пациент плотно охватывает ртом ингалятор. Ингалятор
располагается приблизительно на 4 см перед широко открытым ртом. При этом по
сравнению с обычной ингаляционной техникой различия не существенны.
Улучшает технику ингаляции СПЕЙСЕР. Клапанные спейсеры представляют собой
камеры, удерживающие аэрозоль и ограничивающие необходимость координации вдоха с
нажатием ингалятора. Использование спейсера не исключает, однако, необходимости
правильной ингаляционной техники. Общее поступление препарата в легкие сходное
или более высокое при использовании спейсера по сравнению с только правильной
дозированной ингаляцией.
Сухие порошкообразные ингаляторы (дискхалеры) альтернативная система,
позволяющия доставлять лекарственные вещества в дыхательные пути пациентов путем
инициации дыханием.
АУТОХАЛЕР. Это приспособление автоматически производит ингаляцию при вдохе.
Таким образом, отпадает необходимость в синхронизации дыхания.
У детей раннего возраста или больных, имеющих сложности в использовании
дозированных ингаляторов, применяются растворы или суспензии с помощью
небулайзера (распыления жидких препаратов с помощью компрессора).
Опубликовано с разрешения администрации Русского
Медицинского Журнала.
[ Оглавление книги | Главная страница раздела ]
| Поиск по медицинской библиотеке |
|
|
|
 |
| 
|
|
|
.
.
MedLinks.Ru - Медицина в Рунете версия 4.7.19. © Медицинский сайт MedLinks.ru 2000-2025. Все права защищены.
При использовании любых материалов сайта, включая фотографии и тексты, активная ссылка на www.medlinks.ru обязательна.
|
|

