Данная информация предназначена для специалистов в области здравоохранения и фармацевтики. Пациенты не должны использовать эту информацию в качестве медицинских советов или рекомендаций.
Дефицит тестостерона и соматическая патология
А. Л. Верткин, доктор медицинских наук, профессор
Л. Ю. Моргунов, кандидат медицинских наук
Е. Н. Аринина
Е.С. Колосова
МГМСУ, Москва
Тестостерон является основным половым гормоном, определяющим функционирование
мужского организма. Вместе с дигидротестостероном, андростендионом и их
метаболитами тестостерон создает соответствующий тонус центральной нервной
системы, подкорковых образований, центров автономной нервной системы,
поддерживая функциональную активность половых желез и обеспечивая копулятивную
функцию.
Андрогенная активность тестостерона и его активного метаболита —
дигидротестостерона определяется их эффективным взаимодействием с андрогенными
рецепторами. Основное место образования и секреции тестостерона —
интерстициальные клетки тестикул — клетки Лейдига. Кроме того, биосинтез
определенных, но значительно меньших количеств этого гормона может
осуществляться в коре надпочечников.
Тестостерон, наряду с андрогенными эффектами, способен оказывать мощное
анаболическое действие на различные ткани человека (мышцы, почки, печень,
матку), т. е. увеличивать в них синтез белка. В результате действия на
клетки-мишени реализуется ряд эффектов тестостерона.
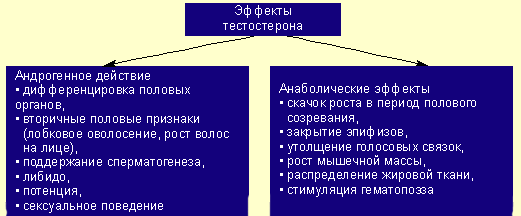
Эффекты тестостерона
По данным Массачусетского исследования по изучению вопросов старения мужчин (MMAS),
количество общего тестостерона снижается с 30–35-летнего возраста на 0,8%, а
свободного тестостерона и связанного с альбумином — на 2% в год, при этом
уровень глобулина, связывающего половые гормоны (ГСПГ), повышается на 1,6% в год
(J Clin Endocrinol Metab, 2002).
В клинической картине андрогенной недостаточности можно выделить несколько
групп симптомов.
- Вегето-сосудистые:
– горячие приливы,
– повышенная потливость,
– сердцебиение,
– кардиалгии.
- Эндокринные нарушения:
– ожирение,
– увеличение грудных желез,
– уменьшение оволосения на лице.
- Костно-мышечные:
– снижение мышечной массы,
– неадекватный физическим нагрузкам прирост мышечной массы,
– боли в костях.
- Психоэмоциональные:
– быстрая утомляемость,
– лабильность настроения со склонностью к депрессиям,
– нарушение памяти,
– снижение творческой продуктивности,
– расстройство сна.
- Трофические нарушения:
– сухость кожи,
– появление морщин.
- Мочеполовые:
– учащенное мочеиспускание,
– ускоренное семяизвержение,
– нарушение эрекции.
Изменения нервно-эмоционального статуса проявляются повышенной
раздражительностью, снижением способности к концентрации внимания, а также
когнитивных функций, творческой продуктивности, функций памяти; депрессией,
нарушениями сна, ощущением снижения жизненной энергии. Поскольку тестостерон
является основным анаболическим гормоном, его дефицит приводит к развитию
соматических нарушений: снижению мышечной массы и силы, увеличению количества
жировой ткани, развитию остеопороза, уменьшению тонуса и толщины кожи.
Считающиеся «прерогативой» женского климакса вегето-сосудистые расстройства —
приливы, потливость, кардиалгии, колебания уровня артериального давления,
чувство нехватки воздуха — также беспокоят мужчин в период развития синдрома
возрастного гипогонадизма.
Тестостерон играет основную роль в становлении сексуальной функции и
формировании полового поведения, поэтому снижение его уровня сопровождается
уменьшением либидо и эректильной дисфункцией.
На сегодняшний день у большинства специалистов не вызывает сомнений как само
существование синдрома дефицита андрогенов (или возрастного гипогонадизма) у
мужчин, так и необходимость его коррекции. Ежегодно на фармацевтическом рынке
появляются все новые и новые препараты тестостерона. Но так было не всегда.
Поиски «эликсира жизни», продолжавшиеся несколько столетий, ознаменовались
величайшим открытием в середине 30-х годов прошлого века структуры тестостерона.
В 1934 г. югославский химик Леопольд Ружичка с коллегами из Федерального
института (г. Цюрих) частично синтезировал андростерон и тестостерон. Другой
ученый, Адольф Бутенандт, один из главных соперников Ружички в области химии
половых гормонов, в августе 1935 г. отправил описание процесса получения
тестостерона из холестерина и самой структуры тестостерона в немецкий журнал
физиологической химии (F. J. Butenandt et al., 1935).
Спустя неделю Ружичка сообщил в швейцарский химический журнал о получении
патента на способ производства тестостерона из холестерола (L. Ruzichka et al.,
1935).
С этого времени началась новая эра лечения проявлений недостаточности
тестостерона.
В течение 2 лет с момента открытия тестостерона в клинической практике
появилось несколько его препаратов, однако вскоре выяснилось, что из-за плохой
растворимости в воде они не могут усваиваться при приеме внутрь в чистом виде.
Поэтому через какое-то время был синтезирован и стал широко применяться
тестостерона пропионат. Так, в 1940 г. H. B. Thomas и R. T. Hill сообщили об
успешном лечении мужского климакса тестостерона пропионатом (H. B. Thomas, R. T.
Hill, 1940). Исследования, проведенные за период 1930 — 1940 гг., показали, что
тестостерон оказывает благоприятное действие на состояние мужского организма в
целом.
Благодаря очевидной эффективности применения препаратов тестостерона с 1940
г. многие врачи стали признавать наличие ряда симптомов, сходных с проявлениями
женской менопаузы, у мужчин среднего возраста.
В 1944 г. Карл Дж. Хеллер и Гордон Б. Майерс в журнале Американской
медицинской ассоциации опубликовали статью «Климакс у мужчин: его симптоматика,
диагностика и лечение», в которой показали, что активность хорионического
гонадотропина у мужчин с климактерическими расстройствами значительно выше, чем
у здоровых; при этом удалось продемонстрировать эффективность инъекций
тестостерона пропионата: у 85% пациентов было отмечено полное исчезновение
вазомоторных, психических и урологических симптомов, а также полное
восстановление либидо (C. G. Heller, G. B. Myers, 1944).
Поскольку продолжительность действия тестостерона пропионата составляла около
3 дней, была предпринята успешная попытка изготовления из сжатых кристаллов
тестостерона капсул цилиндрической формы, которые имплантировались под кожу
ягодиц или живота. В 1953 г. немецкий врач Тиберий Райтер продемонстрировал
эффективное использование имплантатов тестостерона; при этом он первым стал
измерять уровень тестостерона перед началом лечения, показал безопасность
тестостерона в отношении действия на сердечно-сосудистую систему и простату (Tiberius
Reiter// Practicioner. 1953).
Однако победное шествие тестостерон-терапии в 1950-е годы натолкнулось на
стену непонимания большого числа как ученых, так и руководителей
здравоохранения. В частности, успешное применение датскими врачами Моллером и
Твердегаардом инъекций тестостерона у пациентов с перемежающейся хромотой,
буквально спасшее многих от гангрены, вызвало бурную реакцию чиновников из
Датской службы здоровья. В 1957 г. было выдвинуто официальное обвинение в измене
правительству, так как препараты тестостерона не только не входили в число
жизненно важных препаратов, но и не сочетались с понятиями традиционной медицины
того времени. Работы ученых не допускались в печать, не обсуждались на
конгрессах (М. Каррузерс, 2004).
Как уже говорилось выше, в настоящее время проблема назначения препаратов
тестостерона при возрастном гипогонадизме считается практически решенной, однако
зачастую она решается лишь в кругу узких специалистов — урологов, андрологов,
эндокринологов. В то же время подавляющее большинство мужчин в так называемом
переходном возрасте имеют как минимум одно соматическое заболевание. Так, по
данным патологоанатомической службы лечебно-профилактических учреждений г.
Москвы, частота умерших в 2003 г. мужчин с двумя и более заболеваниями составила
от 31% в возрасте 41–50 лет до 62% в возрастной категории от 71 до 80 лет.
Соматическая патология (атеросклероз, ожирение, сахарный диабет, заболевания
печени) вносит значительный вклад как в снижение секреции тестостерона, так и в
его метаболизм. В отличие от здоровых мужчин содержание тестостерона в крови у
мужчин, страдающих перечисленными болезнями, в аналогичном возрасте значительно
ниже (D. Handelsman, 1994; G. Lunglmayr, 1997).
Сердечно-сосудистая патология сегодня занимает ведущее место среди причин
заболеваемости и смертности в развитых странах. При этом распространенность
сердечно-сосудистых заболеваний среди мужчин выше, чем среди женщин, летальность
среди мужчин также существенно превышает таковую среди женщин, особенно в
молодом возрасте. Так, в исследовании The Rancho Bernardo Study показатели
летальности в возрастной категории 50–59 лет составили 10,4% у мужчин и только
1,2% у женщин, в возрасте 60–69 лет — 27,8% и 19% соответственно среди мужчин и
женщин, и только у пожилых людей (70–79 лет) показатели сердечно-сосудистой
смертности среди женщин несколько приблизились к показателям у мужчин —
соответственно 39,1% и 47,6% (D. Goodman-Gruen and E. Barrett-Connor, 1996).
Таким образом, налицо взаимосвязь пола, гормонального статуса и развития
кардиоваскулярной патологии.
Гипогонадизм: круг проблем
Артериальная гипертония является независимым фактором риска ишемической
болезни сердца, и хотя сегодня разработаны стандарты фармакотерапии этого
заболевания, на практике и врачи, и пациенты зачастую сталкиваются с
неэффективностью гипотензивных препаратов и их комбинаций. Возможным объяснением
этому может явиться некорригированный дефицит андрогенов. В доказательство
вышесказанного можно привести тот факт, что еще в 1930 г. наши исследователи
показали, что артериальная гипертония чаще развивается у мужчин со снижением
половой функции (С. И. Карчикян, 1930), а лечение тестостероном оказывает
выраженное гипотензивное действие (Т. Т. Глухенький, 1946).
В это же время появляются первые сообщения о положительном влиянии лечения
тестостероном на течение стенокардии у мужчин, которое проявлялось в уменьшении
выраженности симптомов заболевания и повышении толерантности к физическим
нагрузкам (T. C. Walker et al., 1942). Антиишемическое действие тестостерона
было показано M. D. Jaffe в 1977 г., и позднее (S. Z. Wu, X. Z. Weng, 1993) на
фоне лечения выявлено уменьшение степени депрессии сегмента ST на ЭКГ.
В подавляющем большинстве одномоментных (поперечных) исследований,
проведенных во второй половине XX в., была доказана отрицательная корреляционная
связь между уровнем тестостерона и кардиоваскулярной патологией.
В частности, удалось получить корреляцию между уровнем свободного
тестостерона и степенью окклюзии коронарных артерий: чем ниже был уровень
тестостерона, тем больше степень окклюзии (G. B. Phillips et al., 1994).
В исследовании The South Yorkshire Study (2003) показана высокая
распространенность гипогонадизма у мужчин с ишемической болезнью сердца — 23,4%,
при этом наличие атеросклероза верифицировалось с помощью ангиографии. В данном
исследовании также выявлена положительная корреляция наличия гипогонадизма и
артериальной гипертонии.
За последние 25 лет проведен ряд исследований, результаты некоторых из них
продемонстрировали связь между уровнем тестостерона в сыворотке и показателями
липидного спектра.
В большинстве работ показана положительная корреляционная связь между уровнем
тестостерона и липопротеинами высокой плотности (ЛПВП) и отрицательная — между
содержанием в сыворотке общего холестерина, липопротеинов низкой плотности (ЛПНП)
и тестостерона (Nordoy, 1979; Gutai, 1981; Heller, 1983; Freedman, 1991;
Pottelbergh, 2003). В то же время некоторые исследования демонстрируют
положительное влияние терапии тестостероном на липидный спектр. Так, в работе S.
Zgliczynski и соавторов (1996) выявлено достоверное снижение общего холестерина
и ЛПНП на фоне лечения тестостерона энантатом по 200 мг каждые 2 нед в течение
года.
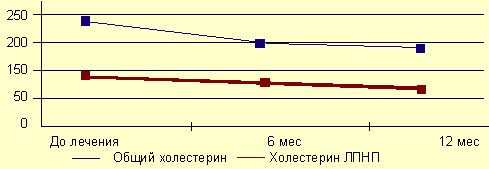
Влияние тестостерона энантата на липидный спектр
Результаты исследования, в котором приняли участие 22 мужчины с острым
инфарктом миокарда, позволяют предположить возможность снижения показателей
смертности от инфаркта миокарда при терапии экзогенным тестостероном.
Динамика уровней тестостерона, эстрадиола и инсулина в течение 6 дней после
развития инфаркта миокарда свидетельствует о том, что низкий исходный уровень
тестостерона ассоциируется с недостаточным инсулиновым «ответом», а также худшим
прогнозом у нестрадающих сахарным диабетом больных с инфарктом миокарда (Peter
J. Pugh, 2001).
У участников данного исследования средний уровень тестостерона плазмы резко
падал в течение первых 2 сут после развития инфаркта миокарда, затем повышался и
к 6-му дню превышал исходные показатели.
В 2004 г. в журнале Heart те же авторы опубликовали результаты
плацебоконтролируемого исследования, посвященного эффективности применения смеси
эфиров тестостерона (сустанон) у мужчин с сердечной недостаточностью. После 12
нед терапии в группе вмешательства была достигнута достоверно лучшая
переносимость физической нагрузки (R. Pugh, D. Jones, 2004).
Kevin S. Channer и его коллеги (Клиника Royal Hallamshire Hospital, Шеффилд)
провели небольшое по объему плацебоконтролируемое исследование, в ходе которого
мужчины со стабильным течением хронической сердечной недостаточности получали
тестостерон по 60 мг/сут.
По сравнению с плацебо тестостерон приводил к существенному повышению
сердечного выброса (p < 0,0001); пик этого эффекта отмечался через 3 ч после
приема гормона. Увеличение сердечного выброса сопровождалось уменьшением
постнагрузки на левый желудочек. На другие гемодинамические параметры
тестостерон не влиял (European Heart Journal, 2003).
Взаимосвязь тяжести бронхолегочной патологии и гормонального статуса, а также
влияние на него лекарственной терапии практически не обсуждаются в отечественной
литературе. В то же время в зарубежных источниках были опубликованы результаты
нескольких исследований по данной проблеме. Еще в 1969 г. Kerrebijnland и
соавторы отметили достоверное увеличение пиковой скорости выдоха у больных с
гормонзависимой бронхиальной астмой на фоне применения этилэстренола (0,1 мг/кг/сут)
по сравнению с плацебо.
U. Aasebo и соавторы (1993) отметили увеличение уровня общего и свободного
тестостерона, снижение содержания ГСПГ, улучшение сексуальной функции на фоне
оксигенотерапии у больных хронической обструктивной болезнью легких (ХОБЛ) с
тяжелой гипоксией и эректильной дисфункцией (J. Steroid Biochem Mol Biol, 1993).
В исследовании Schols и соавторов (1995) отмечено достоверное увеличение
безжировой массы тела и силы дыхательной мускулатуры у мужчин с бронхоэктазами
на фоне лечения нандролона деканоатом в дозе 50 мг каждые 2 нед и усиленного
питания по сравнению с группами, где применялось плацебо и/или усиленное
питание.
В недавнем исследовании R. Casaburi и соавторов (2004) были получены
аналогичные результаты: применение тестостерона энантата 100 мг в неделю в
сочетании с тренировками (по 45 мин 3 раза в неделю) у мужчин с ХОБЛ приводило к
увеличению безжировой массы тела и мышечной силы.
А. Kaminschke и соавторы (1998) при изучении андрогенного статуса у мужчин с
ХОБЛ выявили, что у 100% пациентов, постоянно принимавших системные
глюкокортикостероиды, был снижен уровень тестостерона, тогда как у больных, не
получавших гормональной терапии, низкий уровень тестостерона определялся лишь в
45% случаев. При этом отмечены зависимость концентрации тестостерона от дозы
глюкокортикостероидов, а также худшие результаты теста с 6-минутной ходьбой по
сравнению с контрольной группой (J. Eur Respir, 1998).
При алкогольном циррозе печени повышается уровень ГСПГ, к тому же алкоголь
оказывает токсическое действие на яички, что усугубляет гипогонадизм. В то же
время в надпочечниках продолжается секреция андростендиона. Из-за повреждения
печени андростендион не выводится из организма в виде 17-кетостероидов, а
превращается в эстрогены в разных тканях. Падение уровня тестостерона и
повышение уровня эстрогенов стимулирует синтез ГСПГ. В результате количество
тестостерона, доступного для клеток-мишеней (т. е. свободного и связанного с
альбумином), еще больше снижается. У больных с циррозом печени, как правило,
значительно снижена фертильность, при этом часто выявляется
олигоастенотератоспермия. При гистологическом исследовании яичек выявляются
перитубулярный фиброз и атрофия герминального эпителия (F. Jockenhovel, 2004).
В середине XX в. был проведен ряд исследований по применению тестостерона при
циррозе печени, результаты которых противоречивы. Так, Wells и соавторы (1960)
показали, что применение тестостерона пропионата по 100 мг через день в течение
4 нед привело к более высокой выживаемости, чем в группе плацебо. Аналогичные
результаты были получены Menden и соавторами в 1984 г.: на фоне использования 80
мг оксандролона ежедневно в течение 30 дней продемонстрировано снижение
летальности по сравнению с группой плацебо.
В двух других работах, напротив, применение тестостерона не дало
положительных результатов. В исследовании Fenster и соавторов (1966)
выживаемость в группе больных циррозом печени, применявших тестостерона
пропионат или метенолона ацетат по 100 мг через день в течение месяца,
достоверно не отличалась от таковой в группе плацебо.
Трехлетнее проспективное двойное слепое исследование по применению
микронизированного тестостерона (600 мг в день) (The Copenhagen Study Group for
Liver Disease, 1986) не выявило преимуществ в плане выживаемости, сексуальной
функции, а также по показателям печеночного кровотока, биохимических параметров,
различий в морфологических изменениях печени.
Существует ряд исследований, доказывающих непосредственную связь андрогенного
статуса и тяжести анемии у мужчин. В частности, в исследовании Hamilton и
соавторов было показано, что уровень гемоглобина у мужчин с хирургической
кастрацией достоверно ниже, чем у здоровых пациентов, при этом содержание
гемоглобина не зависело от возраста (Hamilton et al., 1964).
Работы последних лет также демонстрируют наличие тесной взаимосвязи
концентрации гемоглобина и уровня тестостерона. Так, L. Ferrucci и соавторы
(2005) при обследовании 905 пациентов старше 65 лет (критерии исключения:
раковое заболевание, хроническая почечная недостаточность, прием препаратов,
влияющих на уровень гемоглобина) выявили, что уровень гемоглобина коррелировал с
уровнем свободного тестостерона как у мужчин, так и у женщин, кроме того, было
показано, что при низком уровне тестостерона трехлетний риск развития анемии
выше, чем при нормальном уровне (у мужчин — в 7,8 раз, у женщин — в 4,1).
Еще в 1967 г. Vicher и соавторы показали, что терапия андрогенами
способствует улучшению ответа на введение препаратов железа при железодефицитной
анемии. Выживаемость среди пациентов с апластической анемией, применявших
терапию тестостероном в исследовании Camitta и соавторов (1979), составила 70%,
тогда как у больных с пересаженным костным мозгом — лишь 30%.
Аналогичные результаты были получены в исследовании French Cooperative Group
(1986): лечение норэтандролоном или флуоксиместероном 1 мг/кг/сут значительно
увеличивало выживаемость при апластических и рефрактерных анемиях. Более высокая
эффективность гемотрансфузий у пациентов с апластической анемией, получавших
оксиместерон, по сравнению со стандартной терапией плюс плацебо отмечалась в
исследовании Bacigalupo и соавторов (1993).
В работах двух других авторов было продемонстрировано, что терапия
андрогенами приводит к увеличению эффективности применения эритропоэтина у
больных с хронической почечной недостаточностью (Palacio et al., 1983; Wuet et
al., 1991).
Таким образом, суммируя вышеизложенное, можно заключить, что имеется тесная
взаимосвязь соматической патологии, ее тяжести и андрогенного статуса у мужчин.
Кроме того, коррекция гипогонадизма с помощью препаратов тестостерона позволяет
уменьшить выраженность симптомов основного заболевания, повысить качество жизни,
а в ряде случаев повлиять на ее продолжительность.
В настоящее время существует достаточно широкий спектр препаратов
тестостерона для проведения заместительной терапии гипогонадизма. Этот перечень
включает в себя пероральные формы, масляные растворы для внутримышечных
инъекций, а также трансдермальные гели и пластыри. Поскольку все препараты
тестостерона обладают своими преимуществами и недостатками, при выборе метода
гормональной терапии необходимо руководствоваться принципами эффективности,
безопасности и удобства применения.
До сих пор во многих странах наиболее популярны инъекционные формы эфиров
тестостерона, к которым относятся:
- тестостерона пропионат и фенилпропионат,
- тестостерон капронат (деканоат) и изокапронат,
- тестостерона энантат,
- тестостерон ципионат,
- тестостерона ундеканоат,
- тестостерона бициклат,
- комбинация эфиров тестостерона,
- микросферы тестостерона.
В последние годы были созданы препараты для трансдермального использования. К
ним относятся гели тестостерона и дигидротестостерона, а также пластыри.
Тестостерон может быть использован в виде кристаллических имплантатов, вводимых
под кожу, которые обеспечивают равномерное выделение гормона в течение 6 мес.
В нашей стране в настоящее время зарегистрированы комбинированные препараты
для внутримышечного введения, содержащие смесь эфиров тестостерона капроната,
изокапроната, пропионата и фенилпропионата, которые характеризуются разной
фармакокинетикой, что обеспечивает пролонгацию действия препарата. Тестостерона
пропионат начинает действовать быстро, однако к концу первого дня эффект его
практически сводится к нулю, фенилпропионат и изокапронат начинают действовать
примерно через сутки, эффект продолжается до 2 нед, а самый длительно
действующий — капронат — «работает» до 3–4 нед. Существенными недостатками этих
препаратов являются колебания концентрации тестостерона в крови от супра- до
субфизиологических, что ощущается рядом больных, а также необходимость частых
инъекций.
На сегодняшний день перспективным лекарственным средством для заместительной
гормональной терапии андрогенного дефицита является новый препарат тестостерона
ундеканоат.
Небидо — препарат с замедленным высвобождением действующего вещества, поэтому
его можно применять в виде инъекций всего 4 раза в год. Поскольку после инъекций
препарата уровень тестостерона в течение 12 нед поддерживается в физиологических
пределах, без патологических повышений и снижений, такой режим терапии
обеспечивает значительное преимущество перед другими схемами лечения,
предусматривающими в среднем 22 инъекции в год. Важными преимуществами для
пациента являются быстрое наступление эффекта и длительность действия препарата,
позволяющая отказаться от частых визитов к врачу.
Клинические исследования тестостерона ундеканоата продемонстрировали его
высокую эффективность.
В результате его применения отмечаются достоверное увеличение мышечной массы
и силы, снижение количества жировой ткани, повышение сексуального влечения и
улучшение эректильной функции (J. Bresink, 2003; D. Rouskova, 2002).
Такие препараты, возможно, станут «золотым стандартом» заместительной
гормональной терапии, так как они способны устранить дефицит андрогенов —
«слабое звено» кардиоваскулярной патологии.
Статья опубликована в журнале
Лечащий Врач

