Данная информация предназначена для специалистов в области здравоохранения и фармацевтики. Пациенты не должны использовать эту информацию в качестве медицинских советов или рекомендаций.
Результаты исследования GISSI-Prevenzione: Влияние
метаболического синдрома на риск кардиоваскулярных событий у больных, перенесших
инфаркта миокарда в сравнительном аспекте с собственными данными
Нагаева Г.А.1, Нагаев Ш.А.2
1-Республиканский Специализированный Центр
Кардиологии МЗ РУз; 2-Научно-исследовательский институт Иммунологии
АН РУз
Ташкент, Узбекистан.
! Перевод с английского
Санта-Мария-Имбаро, Флоренция, Милан, Павия, Монца, и Порденоне, Италия.
По результатам исследования.
Используемые сокращения:
АПФ – ангиотензинпревращающий фермент;
АГ – артериальная гипертензия;
иАПФ – ингибиторы АПФ;
БАБ – бета-адреноблокаторы;
ИМТ – индекс массы тела;
ХСН – хроническая сердечная недостаточность;
КВС – кардиоваскулярные события;
ИР – инсулинорезистентность;
МС – метаболический синдром;
СД – сахарный диабет;
ИМ – инфаркт миокарда;
ПНЖК – полиненасыщенные жирные кислоты;
ДИ – доверительный интервал;
Общ.ХС – общий холестерин
КРАТКОЕ РЕЗЮМЕ
Цель: Оценить распространенность и прогностическую роль метаболического
синдрома (МС) и сахарного диабета (СД) у пациентов, перенесших инфаркт миокарда
(ИМ).
Предпосылки: Сахарный диабет – известный фактор риска для пациентов с
развившимся инфарктом миокарда, но гликемический дисметаболизм развивается в
течение длительного периода времени. Данные о роли МС у больных с развившимся ИМ
весьма скудны.
Методы: Скорректированная модель регрессии Кокса, включающая СД,
сердечную смерть, основные сердечно-сосудистые осложнения и госпитализацию по
поводу застойной (хронической) сердечной недостаточности (ХСН) за период
наблюдения, как результат кардиоваскулярных событий (КВС), были установлены у
11.323 пациентов, перенесших ИМ, включенных в трайловое исследование
GISSI-Prevenzione.
Результаты: В начале исследования, 21% и 29% пациентов имели СД и МС,
соответственно. Пациенты с МС имели достоверно (93%) высокий риск развития у них
в последующем СД. При сравнении с контрольной группой, вероятность развития
смерти и КВС была высокой, как у пациентов с МС (+29%, p=0.002; +23%, p=0.005),
так и с СД (+68%, p<0.0001; +47%, p<0.0001), хотя пациенты с СД, но не с МС,
чаще госпитализировались по поводу дестабилизации ХСН (+89%, p<0.0003 и +24%, p<0.241).
Умеренное (-6% до -10%) и значительное (> -10%) снижение веса ассоциировалось с
достоверным (18% и 41%, соответственно) снижением риска развития СД. Прибавка
веса имела достоверную связь с увеличением риска развития СД. Риск развития МС и
СД имел бульшую тенденцию среди женщин.
Заключение: У пациентов с ИМ, имелась широкая распространенность МС и СД,
ассоциировавшиеся с увеличением риска смерти и КВС. СД также ассоциировался с
возрастающим риском госпитализаций по поводу дестабилизации ХСН. Уменьшение веса
значительно снижало риск развития СД у пациентов с МС.
(J Am Coll Cardiol 2005; 46:277- 83)©2005 by the American College of
Cardiology Foundation)
СД 2 типа является хорошо известным фактором риска при сердечно-сосудистой
заболеваемости и смертности [1-5]. Однако нарушения метаболизма глюкозы
развивается за долго до того, как у индивидуума отмечается высокий риск развития
КВС, несмотря на то, что уровень глюкозы крови у них может быть в пределах
нормальных величин [6-10]. Этот период характеризуется прогрессированием
устойчивости к действию инсулина, называемому инсулинорезистентностью (ИР),
который обычно сочетается с несколькими кардиоваскулярными факторами риска
[11-15]. Диагностика ИР сложна и не может быть легко выполнена в клинической
практике [16-19], однако МС характеризуется группой факторов риска, связанных с
ИР и считается ранним предиктором нарушения метаболизма глюкозы [20-24]. Диагноз
МС был предложен Национально-Образовательной Программой по Холестерину и Лечению
Взрослых III Группой (NCEP-ATP III), основанной на простых клинических критериях
[20] и считается прогностическим показателем сосудистого риска у пациентов с
установленным заболеванием коронарных сосудов [20-24].
Ввиду малого количества данных о прогностической роли МС у пациентов,
перенесших ИМ [25], мы проанализировали данные GISSI-Prevenzione исследования
[26], с целью оценки распространенности МС и СД, а также их связь с КВС у
пациентов, перенесших ИМ.
МЕТОДЫ
Пациенты. Детальное описание исследования было указано ранее [26].
Вкратце, в исследование GISSI-Prevenzione были включены 11.323 пациента с
недавно перенесенным ИМ (≤3 месяцев, в среднем 16 дней), многоцентровое открытое
клиническое исследование с продолжительностью в 3.5 года, по оценке
эффективности полиненасыщенных жирных кислот (ПНЖК) (1гр. в день) и витамина Е
(300мг. в день). Клинические, лабораторные и инструментальные исследования
пациентов, включенных в исследование, были проведены в начале исследования и в
последующие визиты, которые планировались через 6, 12, 18, 30 и 42 месяца.
Результаты исследования этих анализов показали в последующем развитие СД
(обнаружение гликемии натощак ≥ 126мг/дл или антидиабетической терапии) у
пациентов, которые исходно не имели СД. Все причины смертности, совокупность
частоты КВС (сердечно-сосудистая смерть, нефатальный ИМ, нефатальный инсульт) и
развитие ХСН, ассоциировались с частотой госпитализаций из-за дестабилизации ХСН
у пациентов, исходно не имеющих явления сердечной недостаточности.
Анализ общей смертности и КВС был проведен на 10.384 пациентах (т.е., после
исключения 939 больных, которые на исходном этапе не имели достаточно данных для
диагностики МС). Для анализа развития в последующем СД, мы исключили 2.139
пациентов имевших СД в исходном периоде и 777 больных, у которых не проводилось
измерение уровня глюкозы на дальнейших этапах наблюдения. Анализ госпитализаций
по поводу дестабилизации ХСН был проведен на 8.417 пациентах, не имевших ХСН
(или имели ХСН II ФК по NYHA) на исходном этапе или полная информация для оценки
ХСН была собрана, хотя бы, на одном из запланированных последующих этапах
наблюдения.
Оценка эффективности изменения веса на риск дальнейшего развития КВС и СД
была проведена на 7.027 пациентах, которым измерение массы тела было проведено,
как в исходном периоде, так и при первом запланированном визите и которые до
этого не имели ни КВС, ни СД. Мы также оценили влияние изменения веса у 4.422
пациентов с индексом массы тела (ИМТ) > 25кг/м2. В качестве группы
сравнения мы решили взять пациентов, у которых не было снижения массы тела или
снижение веса было незначительным (< -5%). Изменение веса тела, между исходным
периодом и первым плановым визитом, определялось как умеренное - при снижении
веса от -6% до -10%, и как значительное – при снижении веса > -10%; тогда как
увеличение массы тела считалось легким при прибавке веса от ≥ 0% до +5%,
умеренным – от +6% до +10% и значительным – при увеличении массы тела > +10%.
Для диагностики МС в исходном периоде мы изменили критерии NCEP-ATP III для
абдоминального ожирения, используя средние значения ИМТ ≥ 26кг/м2,
вместо измерения окружности талии, которое не всегда доступно. Были выбраны
средние значения ИМТ, определяющие избыточный вес, а значения, превышающие
верхнюю границу нормы свидетельствовали о проксивисцеральном ожирении.
Соответственно, диагноз МС выставлялся тогда, когда лица без СД, имели, по
крайней мере, три из следующих пяти критериев: висцеральное ожирение (ИМТ ≥ 26
кг/м2), высокий уровень триглицеридов (ТГ) (≥ 150 мг/дл), снижение уровня
липопротеидов высокой плотности (ЛПВП) (< 40 мг/дл у мужчин и < 50 мг/дл у
женщин), гипертензию (САД ≥ 130мм.рт.ст., или ДАД ≥ 85мм.рт.ст., или наличие в
анамнезе АГ, или прием антигипертензивных препаратов) и нарушение гликемии
натощак (≥ 110мг/дл, но < 126мг/дл). Для диагностики МС мы провели
чувствительный анализ значений ИМТ 28 и 29 кг/м2 (соответствующие верхнему
квартилю и верхнему квинтилю) без достоверной разницы в сроках по
прогностическому влиянию МС (данные не представлены). СД в исходном периоде
диагностировался, если уровень глюкозы крови составлял ≥126мг/дл, или пациенты
принимали сахароснижающую терапию, или врач сообщал о наличие у данного пациента
СД.
Статистические методы.
Односторонний дисперсинный анализ и вычисление χ2 использовались
для оценки значений как в исходном периоде, так и на этапах. Пропорциональная
модель Кокса была приспособлена для оценки всех причин смертности, КВС, поздней
диагностики ХСН и вновь выявленного СД за период наблюдения. Следующие
потенциальные факторы риска были включены в мультивариационную модель:
возраст и пол;
электрическая нестабильность миокарда (определяемая как ≥10 желудочковых
экстрасистол в час; устойчивые или повторяющиеся аритмии, зафиксированные при
24 часовом Холтеровском мониторировании), резидуальная/остаточная ишемия
(явления стенокардии, положительная нагрузочная проба), фракция выброса;
курение, уровень общего холестерина, заболевания периферических сосудов;
приём омега-3 ПНЖК, витамина Е, иАПФ, статинов и БАБ
Мультивариационная модель, целью которой была оценка эффективности снижения
веса на риск развития в последующем СД, также включала измерение уровня ИМТ в
исходном периоде. Пропорциональная модель Кокса по случаям выживаемости была
представлена в виде графиков. Все вероятные значения были двусторонними. Все
расчеты проводились с использованием статистических пакетов SAS (SAS Institute
Inc, Кэри, Северная Каролина).
РЕЗУЛЬТАТЫ
Статистические данные, описанные в исходном периоде. Из всех 10.384
пациентов 2.139 (20,6%) имели СД и 3.047 (29,3%) имели МС (таб.1). По сравнению
с пациентами с МС и контрольной группой, у больных с СД превалировали лица
женского пола, старший возраст, более высокая распространенность заболеваний
периферических артерий и перенесенный в анамнезе ИМ – показатели, на основании
которых пациенты включались в исследование. Пациенты с СД также
характеризовались нарушенной функцией левого желудочка со сниженным уровнем
фракции выброса и большей распространенностью явлений ХСН II ФК по NYHA. Что
касается лекарственных препаратов, пациенты с СД чаще принимали иАПФ и реже –
аспирин и БАБ (таб.1).
Пациенты контрольной группы и с МС были более похожи между собой, последняя
группа характеризовалась превалированием женщин (12,3% против 15,4%, р<0,0001),
более частым использованием БАБ, иАПФ и аспирина (таб.1). Были некоторые
минимальные различия в исходном периоде между пациентами, которые были включены
в исследование и теми, кто не был включен из-за отсутствия данных. Исключенные
из исследования пациенты, по сравнению с вошедшими в анализ больными, были
моложе (58 против 60 лет); имели меньшую частоту встречаемости II ФК ХСН по NYHA
(8% против 10%) и реже принимали антитромбоцитарные препараты (85% против 92%) и
БАБ (36% против 45%).
Непосредственные результаты. По сравнению с контрольной группой (рис.1 и
2, таб.2) вероятность смерти и КВС была как у больных с МС (+29%, р=0,002; +23%,
р=0,005), атк и у пациентов с СД (+68%, р<0,0001; +47%, р<0,0001). Пациенты с СД,
но не с МС (рис.3, таб.2), чаще госпитализировались по поводу дестабилизации ХСН
(+89%, р=0,0003), а пациенты с МС – реже (+24%, р=0,241), в сравнению с
контрольной группой. Дополнительно, необходимо отметить почти двукратное
увеличение риска развития СД (+93%, р<0,0001; рис.4), у пациентов с МС
наблюдалось резкое увеличение риска развития СД по мере увеличения числа
диагностических компонентов МС. Среди пациентов с МС 2120 (70%), 841 (28%) и 86
(3%) имели три, четыре и пять диагностических компонентов МС, соответственно. По
сравнению с пациентами с тремя компонентами МС, риск развития СД был на 60% (р<0,0001)
и 273% (р<0,0001) выше у пациентов с четырьмя и пятью компонентами диагностики
МС, соответственно (рис.5).
Пациенты с СД и тремя диагностическими компонентами МС имели существенное 40%
(р=0,067) увеличение риска смерти по сравнению с пациентами, имеющими четырех- и
пятикомпонентный МС, однако никакой очевидной разницы между риском развития КВС
между этими указанными группами выявлено не было (р=0,708).
В анализе подгрупп было выявлено, что риск развития СД (169% против 86%, р=0,092),
смертности (40% против 29%, р=0,679) и КВС (51% против 20%, р=0,298) был выше у
женщин, чем у мужчин, хотя различия не были статистически-значимыми.
У 7.027 пациентов изменение веса в течение первых 6 месяцев наблюдения
сопровождалось значительным влиянием на вероятность развития СД (рис.6).
Сравнительная оценка пациентов, у которых снижение веса составило < 5% (n=2.066;
29,4%) характеризовалась увеличением риска развития СД и составила на 48%, 57% и
113% выше у лиц с легкой (n=2.749; 39,1%; р<0,0001), умеренной (n=889; 12,6%; р<0,0001)
и значительной (n=3966; 5,6%; р<0,0001) прибавкой в весе, соответственно. Но
пациенты, кто достиг умеренного (n=678; 9,6%) или значительного (n=249; 3.5%)
снижения веса, характеризовались снижением риска развития СД на 18% (p=0.1664) и
41% (p<0.0275) за период наблюдения, соответственно. Анализ по подгруппам у
4.422 пациентов с ИМТ > 25кг/м2 показал, что все уровни изменения
массы тела были незначительными, но достоверно снижающими риск развития СД, по
сравнению с пациентами, у которых не было ни одного свидетельства снижения веса
(n=1.470; 33,2%), характеризующихся увеличением риска на 50%, 63% и 121% при
легком (n=1.581; 35.8%, p<0.0001), умеренном (n=454; 10.2%, p<0,0001) и
значительном (n=141; 3.2%, p<0,0001) увеличении массы тела, соответственно.
Однако, пациенты, достигшие умеренного (n=550; 12,4%) и значительного (n=226;
5,1%) снижения массы тела характеризовались 15% (p=0,278) и 45% (p< 0.02)
снижением риска развития СД за период наблюдения, соответственно.
Изменение веса в течение первых 6 месяцев наблюдения не выявило какого-либо
существенного эффекта по риску развития КВС у всех 7.027 пациентов или у 4.422
пациентов с избыточной массой тела (данные не представлены).
Результаты по эффективности лечения омега-3 ПНЖК и витамином Е не
противоречили основным результатам исследования и не имели существенных различий
в подгрупповых вариациях пациентов, рассматриваемых в данном анализе (р для
разнородности = Не уточнено).
ОБСУЖДЕНИЕ
Основные результаты этого анализа следующие: 1) у пациентов, у которых был ИМ
в течение предыдущих трех месяцев, чаще обнаруживалась ИР, так как 50% пациентов
уже имели СД 2 (20,6%) типа или МС (29,3%); 2) оба состояния ассоциировались с
неблагоприятным прогнозом по условиям смертности от всех причин и КВС; 3)
пациенты с СД, но не с МС, имели высокий риск госпитализаций из-за
дестабилизации ХСН; 4) МС являлся сильным (главным) предиктором развития СД и
это ассоциировалось с количеством диагностических компонентов МС; 5) риск
развития СД уменьшался или увеличивался пропорционально величинам изменения
веса.
Согласно нашим исследованиям, дисметаболизм глюкозы затрагивает 50%
пациентов, перенесших ИМ. Хотя наши результаты по СД сопоставимы с данными
литературы [2-5], высокая распространенность пациентов с МС, также как и
неблагоприятный прогноз, подчеркивают необходимость акцентирования внимания на
этом синдроме у пациентов, перенесших ИМ. Как и в первичной профилактике [21],
МС является сильным (главным) предиктором для вновь выявленного СД у больных,
перенесших ИМ. Мы обнаружили прямую (сильную) связь между числом факторов,
составляющих МС, и риском развития СД в последующем, который, возможно,
определяется увеличением уровней гиперинсулинемии и ИР, ассоциирующихся с
прогрессирующим нарастанием риска. В исследовании Bruneck [27], ИР коррелировала
с числом составляющих МС и, почти, всегда свидетельствовала о воздействии
нескольких компонентов одновременно. Этот факт подчеркивает необходимость
лечения этих пациентов, чтобы избежать в последующем развития СД. Образ жизни и
привычки играют важную роль в этом отношении, и мы обнаружили, что
неблагоприятное изменение веса, точнее, его увеличение, в течение первых 6
месяцев после перенесенного ИМ ассоциировалось с повышенным риском развития СД.
Это подтверждает предыдущие высказывания, что соблюдение диеты, повышение
физической активности, снижение веса (с или без фармакологического лечения)
могут снизить риск развития СД более чем на 50% [28-30].
Диагноз МС ассоциировался с высоким риском развития КВС при сравнении с
пациентами контрольной группы, но был гораздо ниже, чем у пациентов с СД. Риск
смерти среди пациентов с МС в основном ассоциировался с трансформацией в СД. На
самом деле, доля летальности за последние 2,5 года наблюдения среди лиц, у
которых в исходном периоде был СД, или среди пациентов с МС, у которых СД
развился в течение первого года наблюдения, составила 9,2% и 6,5%,
соответственно. Наоборот, контрольная группа и пациенты с МС, у которых в
течение первого года исследования не наблюдалось развития СД, имели идентичные
показатели риска смерти за последние 2,5 года наблюдения (4,7% и 5%,
соответственно). Эти результаты позволяют предполагать, что МС – это синдром,
занимающий промежуточное положение между здоровыми лицами и пациентами с СД:
около 10% пациентов с МС стали диабетиками через 1 год наблюдения и риск смерти
у них увеличился, заняв промежуточное положение между контрольной группой и
пациентами с СД на начальном этапе исследования. По сообщения за последние
несколько лет, ИР манифестируется до начала гипергликемии, а МС может быть
индикатором состояния ИР или гиперинсулиемии [20, 31-33] при нормальном уровне
глюкозы крови. Из-за сложности отношений с гиперинсулинемией, по сравнению с
гипергликемией [11, 34-36], МС может представлять собой ранний индикатор
повышенного сосудистого риска, в то время как СД мог бы рассматриваться как
последняя ступень прогрессирующего и долгосрочного явления с вовлечением ИР
[6-10].
Результаты нашего исследования подчеркивают необходимость преждевременного
выявления и более агрессивного лечения пациентов с МС и коронарной болезнью
сердца, у которых абсолютный кардиоваскулярный риск безусловно выше, чем при
первичной профилактике. Эти данные подтверждают клиническую значимость МС в
диагностике СД и выявлении пациентов с высоким риском тяжелых осложнений,
которые могут быть предупреждены путем специфического профилактического
фармакологического лечения, направленного на нормализацию уровня липопротеидов
низкой плотности [37]. Эти результаты также подтверждаются в предыдущих
исследованиях по прогностической роли МС как у пациентов без коронарной болезни
сердца, так и у тех, кто перенес ИМ [21-24].
Мы заметили, что риск развития МС и СД, как правило, выше среди женщин,
нежели среди лиц мужского пола, несмотря на проводимую коррекцию основных
факторов риска. Причины данного явления выяснить не удалось, но мы предполагаем,
что, возможно, это связано с более тяжелой (трудной) переносимостью воздействия
основных и дополнительных факторов риска [38].
В нашем исследовании пациенты с СД, но не с МС, имели высокий риск
госпитализаций по поводу дестабилизации ХСН. Исследование UKPDS (The United
Kingdom Prospective Diabetes Study) показало, что на каждый 1% снижения уровня
гликированного гемоглобина (HbA1C) наблюдалось 16%-е снижение риска сердечной
недостаточности у больных с СД [39]. Однако, под определением ХСН мы понимали
тяжелые состояния (т.е. дестабилизацию ХСН, требующую госпитализации), поэтому
малое число случаев могло не иметь статистического значения; пациенты с СД могли
иметь более тяжелые формы ХСН, требующие госпитализации.
Ограничения в исследовании. Ресурсы нашего исследования были ограничены
отправлением анализов и для определения ожирения мы адаптировали произвольно
выбранные точки. На сегодняшний день, не существует единого мнения по уровню ИМТ,
который мог бы считаться эквивалентным с окружностью талии/живота [40-44], и в
итоге мы выбрали уровень ИМТ ≥ 26кг/м2, потому что чувствительность анализа при
уровне ИМТ 28 и 29 кг/м2 (соответственно верхний квартиль и верхний квинтиль) не
выявила различий в прогностическом значении МС. Кроме того, область получаемых
кривых при использовании трех различных точек рассмотрения – 26, 28 и 29, не
имеет существенно разных результатов.
В заключение, МС и СД – это два состояния, связанные с ИР – обнаруживались у
половины пациентов перенесших ИМ и ассоциировались с прогрессирующим ухудшением
прогноза, несмотря на предпринятые профилактические меры. Это предполагает
возможность применения более агрессивной терапевтической стратегии, включающей в
себя – модификацию образа жизни как краеугольный камень.
Таблица 1. Исходные характеристики 10.384 пациентов по
данным GISSI-Prevenzione
| Признаки |
Контрольная гр. (n=5.198) |
Пациенты с МС (n=3.047) |
Пациенты с СД (n=2.139) |
р |
| Ср.возраст, лет |
59,0±10,8 |
58,6±10,3 |
61,9±9,6 |
<0,0001 |
| Женщины, n (%) |
638 (12,3) |
468 (15,4) |
441 (20,6) |
<0,0001 |
| Перенесенный ИМ, n (%) |
586 (11,3) |
358 (11,8) |
315 (14,8) |
0,0001 |
| Общ.ХС, мг/дл |
209±42 |
216±41 |
207±44 |
<0,0001 |
| Заб.-я периф. артерий, n (%) |
195 (3,8) |
102 (3,4) |
174 (8,1) |
<0,0001 |
| ФК II ХСН
(по NYHA), n (%) |
471 (9,1) |
271 (8,9) |
320 (15,0) |
<0,0001 |
| ФВ ЛЖ, % |
53±10 |
53±10 |
51±11 |
<0,0001 |
| Антитромбоцитарные препараты, n (%) |
4.769 (91,7) |
2.819 (92,5) |
1.928 (90,1) |
0,009 |
| БАБ, n (%) |
2.350 (45,2) |
1.523 (50,0) |
776 (36,3) |
<0,0001 |
| Cтатины, n (%) |
1.116 (22,1) |
628 (21,4) |
390 (19,2) |
0,0258 |
| иАПФ, n (%) |
2.150 (41,4) |
1.500 (49,2) |
1.211 (56,6) |
<0,0001 |
Примечание: ср. – средний; n – количество; ИМ – инфаркт миокарда, общ.ХС –
общий холестерин; ФК – функциональный класс; ХСН – хроническая сердечная
недостаточность; ФВ ЛЖ – фракция выброса левого желудочка; БАБ –
бета-адреноблокаторы; иАПФ – ингибиторы антиотензинпревращающего фермента; р
–достоверность различий.
Таблица 2. Заключительная (конечная) прогностическая модель
общей смертности, КВС, госпитализаций по поводу дестабилизации ХСН и вновь
выявленного СД у пациентов контрольной группы, с МС и с наличием СД,
откорректированная по факторам риска (см.Методы): частота встречаемости
(распространенность), относительный риск, 95%-й доверительный интервал и р –
значение
| Показатели |
Общая смертность |
КВС |
Госпитализация из-за ХСН |
СД вновь выявленный |
| Контрольная группа |
5.198 |
5.198 |
4.306 |
4.737 |
| n случаев (%) |
384 (7,4) |
456 (8,8) |
71 (1,6) |
454 (9,6) |
| ОР (95% ДИ) |
1,00 |
1,00 |
1,00 |
1,00 |
| р - значения |
- |
- |
- |
- |
| Пациенты с МС |
3.047 |
3.047 |
2.522 |
2.731 |
| n случаев (%) |
258 (8,5) |
316 (10,4) |
50 (2,0) |
486 (17,8) |
| ОР (95% ДИ) |
1,29 (1,10-1,51) |
1,23 (1,06-1,42) |
1,24 (0,86-1,79) |
1,93 (1,69-2,19) |
| р - значения |
0,002 |
0,005 |
0,241 |
<0,0001 |
| Пациенты с СД |
2.139 |
2.139 |
1.589 |
- |
| n случаев (%) |
310 (14,5) |
411 (19,2) |
62 (3,9) |
- |
| ОР (95% ДИ) |
1,68 (1,44-1,95) |
1,47 (1,27-1,70) |
1,89 (1,34-2,67) |
- |
| р - значения |
<0,0001 |
<0,0001 |
0,0003 |
- |
Примечания: n – частота встречаемости (распространенность); ОР –
относительный риск; 95% ДИ – 95%-й доверительный интервал; р – достоверность
различий
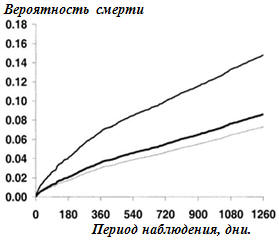 |
Примечания: графики выживаемости
пациентов – контрольной группы (нижняя линия), группы с МС (средняя линия)
и пациентов с СД (верхняя линия). Контрольная группа – ОР=1.00
(сравнительная категория); пациенты с МС – ОР=1.29, 95%-й ДИ 1.10 до 1.51,
р=0,002; пациенты с СД – ОР=1.68, 95%-й ДИ 1.44 до 1.95, р<0,0001.
Пропорциональная модель Кокса, откорректированная для возраста, пола,
курения, уровня общего холестерина, наличия заболеваний периферических
сосудов, электрическая неустойчивости миокарда, стенокардии, фракции
выброса левого желудочка, применения омега-3 ПНЖК и витамина Е, а также
антитромбоцитарных препаратов, иАПФ, статинов в течение 6 месяцев и БАБ.
|
Рисунок 1.
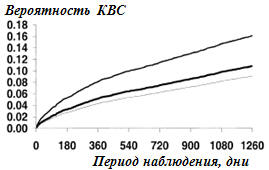 |
Примечания: графики выживаемости без КВС
контрольной группы (нижняя линия), группы с МС (средняя линия) и пациентов
с СД (верхняя линия). Контрольная группа – ОР=1.00 (сравнительная
категория); пациенты с МС – ОР=1.23, 95%-й ДИ 1.06 до 1.42, р =0,005;
пациенты с СД – ОР=1.47, 95%-й ДИ 1.27 до 1.70, р<0,0001. Методы как на
рис.1. |
Рисунок 2.
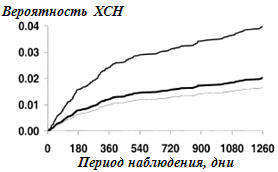 |
Примечания: кривая госпитализаций без ХСН
контрольной группы (нижняя линия), группы с МС (средняя линия) и пациентов
с СД (верхняя линия). Контрольная группа – ОР=1.00 (сравнительная
категория); пациенты с МС – ОР= 1.24, 95%-й ДИ 0,.86 до 1.79, р =0,241;
пациенты с СД – ОР=1.89, 95%-й ДИ 1.34 до 2.67, р=0,0003. Методы как на
рис.1. |
Рисунок 3.
 |
Примечания: графики
выживаемости без СД контрольной группы (тонкая линия), группы с МС
(толстая линия). Контрольная группа – ОР=1.00 (сравнительная категория);
пациенты с МС – ОР=1.93, 95%-й ДИ 1.69 до 2.19, р<0.0001. Методы как на
рис.1. |
Рисунок 4.
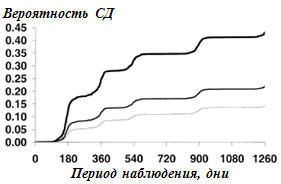 |
Примечания: кривая выживаемости лиц без СД
в зависимости от числа диагностических компонентов МС: три компонента –
нижняя линия, четыре компонента – средняя линия и пять компонентов –
верхняя линия. Трехкомпонентный МС – ОР=1,00 (сравнительная категория);
четырехкомпонентный МС – ОР=1,60, 95% ДИ 1.32-1.93, р<0,0001;
пятикомпонентный МС – ОР=3,73, 95% ДИ 2.58 до5.39, р<0,0001. методы как на
рис.1 |
Рисунок 5.
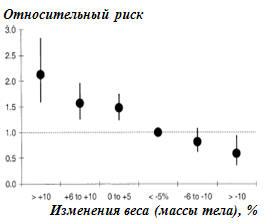 |
Примечания: относительный риск по СД во
взаимосвязи с изменениями массы тела за 6 месяцев наблюдения.
Сравнительная категория: изменение веса < -5% (ОР= 1,00); изменение веса
от 0% до +5% (ОР=1,48; 95% ДИ 1.25 до 1.75; р<0,0001); изменение веса от
+6% до +10% (ОР=1,57; 95% ДИ 1.26 до 1.96; р<0,0001); изменение веса >
+10% (ОР=2,13; 95% ДИ 1.60 до 2.83; р<0,0001); изменение веса от -6% до
-10% (ОР=0,82; 95% ДИ 0.63 до 1.08; р=0,1664); изменение веса > -10%
(ОР=0,59; 95% ДИ 0.37 до 0.94; р<0,0275). Пропорциональная модель Кокса,
откорректированная для возраста, пола ИМТ, курения, общ.ХС, количества
компонентов МС, наличия заболеваний периферических сосудов, электрической
нестабильности миокарда, стенокардии, ФВ ЛЖ, употребления омега-3 ПНЖК,
витамина Е, антитромбоцитарных препаратов, иАПФ, статинов в течение 6 мес.
и БАБ. |
Рисунок 6.
СОБСТВЕННЫЕ РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ.
На базе клиники РСЦК было обследовано 79 мужчин с Q-ИМ, ср.возраст=51,75±8,91
(от 26 до 73) лет. На 10-14 день ОИМ были проведены следующие исследования:
физикальный осмотр, общеклинические лабораторные исследования, липидный спектр
крови, ЭКГ, ЭхоКГ и 24-часовое мониторирование ЭКГ. МС диагностировался по
критериям IDF (2005). В зависимости от наличия или отсутствия МС пациенты были
разделены на 2 группы: 1гр. – 52 с МС (ср.возраст=51,48±8,38 лет) и 2гр. – 27
без МС (ср.возраст=52,63±9,13 лет). Повторные обследования проводились через 3,
6 и 12 месяцев. Всем пациентам назначалась базисная терапия: нитраты, БАБ –
β-адреноблокаторы, иАПФ – ингибиторы АПФ, АК – антагонисты кальция,
антиагреганты, статины.
Результаты: На исходном этапе было выявлено, что ранняя постинфарктная
стенокардия в 1гр. наблюдалась у 30 (57,69%), а во 2 гр. - у 8 (29,63%)
пациентов (р=0,033; χ2=4,539); аневризма стенок ЛЖ у 10 (19,23%) – в
1гр. и у 5 (18,52%) пациентов – во 2гр. (р=0,821; χ2=0,051). Пациенты
с МС характеризовались достоверно бульшим содержанием триглицеридов и
коэффициентом атерогенности холестерина. В тоже время уровень ХС липопротеидов
высокой плотности (ЛПВП) достоверно превалировал у пациентов 2гр. (р=0,000)
(см.таб.3). Уровень С-РБ в 1гр.=9,81±13,61мг/л, во 2гр.=4,07±3,22 (р=0,034).
Таблица 3. Сравнительная оценка показателей липидного
спектра крови.
| Признак |
с МС (n=52) |
без МС (n=27) |
р |
| Общ.ХС |
198,46±45,70 |
207,41±43,76 |
0,405 |
| ТГ мг/дл |
250,17±120,81 |
161,00±97,09 |
0,001 |
| ХСЛПВП мг/дл |
33,13±7,65 |
39,85±6,09 |
0,000* |
| ХСЛПОНП мг/дл |
56,50±33,51 |
50,52±57,66 |
0,561 |
| ХСЛПНП мг/дл |
147,79±43,33 |
135,15±50,79 |
0,250 |
| Ка ХС |
5,26±2,01 |
4,26±1,22 |
0,021 |
Примечания: n-количество больных; р-достоверность различий; общ.ХС-общий
холестерин; ТГ-триглицериды; ХСЛПВП-холестерин липопротеидов высокой плотности;
ХСЛПОНП – очень низкой плотности; ХСЛПНП-низкой плотности; КА-коэффициент
атерогенности.
Со стороны ЭхоКГ-параметров: толщина МЖП в 1гр.=1,17±0,34см, во 2гр.=
1,14±0,25см. Также у пациентов с наличием МС как линейные, так и объемные
показатели ЛЖ превышали аналогичные показатели группы сравнения, но не достигали
уровня достоверности (все р>0,05). ФВ ЛЖ 1гр.= 51,10±6,50%, во 2гр.= 55,60±5,20%
(р=0,003). В 1гр. масса миокарда (ММ ЛЖ)=270,00±88,90гр, что на 1,96% превышало
ММЛЖ во 2гр. (р=0,795). У пациентов 1гр. мы наблюдали прямую корреляционную
зависимость между уровнем С-РБ и толщиной МЖП (r = 0,716; t = 2,902; p = 0,019)
(см.рис.7).
Через 3 месяца в группе больных с МС, по сравнению с контрольной группой,
частота повторных госпитализаций по поводу дестабилизации ИБС (без повторных ИМ)
составила 11,5% (6 больных) против 3,7% (1 больной) в группе сравнения. Анализ
причин дестабилизации показал, что в 1гр. в 3 случаях пациенты самостоятельно
прекратили прием рекомендованных лекарственных препаратов (ЛП), у 1 больного
нарушенная толерантность к глюкозе (НТГ) переросла в СД и в 2 случаях –
возможной причиной дестабилизации ИБС было нарушение режима питания, т.к. у
данных пациентов отмечалось увеличение массы тела. Во 2гр. дестабилизация ИБС,
вероятно, была обусловлена эмоционально-стрессовым потрясением, сопровождавшимся
явлением гипергликемии, что потребовало немедленной госпитализации и назначения
инсулинотерапии.
Рисунок 7.
| Корреляционная зависимость уровня С-РБ с
толщиной межжелудочковой перегородки.
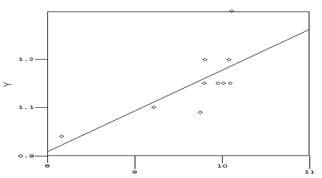 |
Примечания: на представленном рисунке –
корреляционная зависимость между уровнем С-РБ (ось Х) и толщиной
межжелудочковой перегородки (ось Y). |
Спустя 6 месяцев в группе больных с МС частота повторных госпитализаций
составила 25% (13 больных). Из них в 1 случае развился повторный ИМ; у 3 больных
наблюдалась дестабилизация ИБС; у 4 больных НТГ переросла в СД; и у оставшихся 5
пациентов причина ухудшения самочувствия заключалась в самостоятельной отмене ЛП.
В группе сравнения аналогичные показатели (18,5% - 5 больных) составили – 0, 2,
1 и 2 больных, соответственно (см.рис.8).
Через 1 год наблюдения оценка состояний исследуемых пациентов выявила
следующее: в 1гр. случаи повторной госпитализации составили 30,8% (16 больных),
а во 2гр. – 25,9% (7 больных). Подробный анализ причин госпитализаций в 1гр.
пациентов выявил: в 3 случаях была проведена ангиопластика со стентированием
коронарных артерий, в 1 случае – АКШ, в 2 случаях развился фатальный инфаркт
миокарда и у 1 пациента – наблюдалась прогрессирующая стенокардия напряжения с
проведением неотложного кардиореанимационного лечения; у 3 пациентов отмечалась
трансформация НТГ в СД; еще в 3 случаях, возможной причиной дестабилизации мы
рассматривали несоблюдение диетических рекомендаций и увеличение массы тела и, в
оставшихся 3 случаях пациенты самостоятельно прекратили прием рекомендованных ЛП.
Во 2гр. было установлено: дестабилизация ИБС с проведением ЧКВ и стентированием
– в 3 случаях и в 1 случае – АКШ, нефатальный повторный инфаркт миокарда
развился у 1 больного; в оставшихся 2 случаях пациенты самостоятельно прекратили
прием рекомендованных ЛП.
Рисунок 8. Сравнительный анализ числа дестабилизаций
сердечно-сосудистых состояний в сравниваемых группах пациентов.
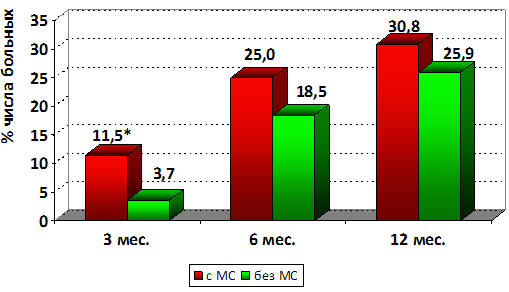
Как видно на рис.8, явления дестабилизации ИБС, в первые 3 месяца наблюдения,
достоверно чаще регистрировались у лиц 1гр., т.е. с наличием МС, однако, на
последующих этапах (6 и 12 мес.) различия не достигали уровня достоверности и
также превалировали у лиц с наличием МС. Но, хотелось бы отметить, что к концу
первого года исследования различия, по числу госпитализаций исследуемых групп
пациентов, были малосущественными, составив всего 4,9%.
Т.о., результаты, проведенного нами исследования во-многом созвучны с данными
описанного выше исследования GISSI-Prevenzione и также свидетельствуют о
неблагоприятном воздействии метаболического синдрома на течение и прогноз жизни
пациентов с перенесенным инфарктом миокарда.
Литература
- Haffner SM, D’Agostino R Jr., Mykkanen L, et al. Insulin sensitivityin
subjects with type 2 diabetes. Relationship to cardiovascular risk factors:
the Insulin Resistance Atherosclerosis Study. Diabetes Care 1999;22:562– 8.
- Brand FN, Abbott RD, Kannel WB. Diabetes, intermittent claudication, and
risk of cardiovascular events. The Framingham Study. Diabetes 1989;38:504 –9.
- Pan WH, Cedres LB, Liu K, et al. Relationship of clinical diabetes and
asymptomatic hyperglycemia to risk of coronary heart disease mortality in men
and women. Am J Epidemiol 1986;123:504 –16.
- Stamler J, Vaccaro O, Neaton JD, Wentworth D. Diabetes, other risk factors,
and 12-yr cardiovascular mortality for men screened in the Multiple Risk
Factor Intervention Trial. Diabetes Care 1993;16:434–44.
- Balkau B, Shipley M, Jarrett RJ, et al. High blood glucose concentration
is a risk factor for mortality in middle-aged nondiabetic men. 20-year
follow-up in the Whitehall Study, the Paris Prospective Study, and the
Helsinki Policemen Study. Diabetes Care 1998;21:360 –7.
- Goldstein BJ. Insulin resistance: from benign to type 2 diabetesmellitus.
Rev Cardiovasc Med 2003;4 Suppl 6:S3–10.
- Warram JH, Martin BC, Krolewski AS, Soeldner JS, Kahn CR. Slow glucose
removal rate and hyperinsulinemia precede the development of type II diabetes
in the offspring of diabetic parents. Ann Intern Med 1990;113:909 –15.
- Charles MA, Fontbonne A, Thibult N, Warnet JM, Rosselin GE, Eschwege E.
Risk factors for NIDDM in white population. Paris prospective study. Diabetes
1991;40:796 –9.
- Sicree RA, Zimmet PZ, King HOM, Coventry JS. Plasma insulin response among
Nauruans: prediction of deterioration in glucose tolerance over 6 years.
Diabetes 1987;36:179–86.
- Lillioja S, Mott DM, Spraul M, et al. Insulin resistance and insulin
secretory dysfunction as precursors of non-insulin dependent diabetes mellitus.
Prospective studies of Pima Indians. N Engl J Med 1993; 329:1988 –92.
- Haffner SM, Stern MP, Hazuda HP, Mitchell BD, Patterson JK. Cardiovascular
risk factors in confirmed prediabetic individuals. Does the clock for coronary
heart disease start ticking before the onset of clinical diabetes? JAMA
1990;263:2893– 8.
- McPhillips JB, Barrett-Connor E, Wingard DL. Cardiovascular disease risk
factors prior to the diagnosis of impaired glucose tolerance and non-insulin
dependent diabetes mellitus in a community of older adults. Am J Epidemiol
1990;131:443–53.
- Medalie JH, Papier CM, Goldbourt U, Herman JB. Major factors in the
development of diabetes mellitus in 10,000 men. Arch Intern Med
1975;135:811–17.
- The DECODE Study Group. European Diabetes Epidemiology Group. Glucose
tolerance and mortality: comparison of WHO and American Diabetes Association
diagnostic criteria. Diabetes epidemiology: collaborative analysis of
diagnostic criteria in Europe. Lancet 1999;354:617–21.
- Saydah SH, Loria CM, Eberhardt MS, Brancati FL. Subclinical states of
glucose intolerance and risk of death in the U.S. Diabetes Care
2001;24:447–53.
- Laakso M. How good a marker is insulin level for insulin resistance? Am J
Epidemiol 1993;137:959–65.
- Stern MP, Williams K, Haffner SM. Identification of individuals at high
risk of type 2 diabetes: do we need the oral glucose tolerance test? Ann
Intern Med 2002;136:575– 81.
- Stern MP, Fatehi P, Williams K, Haffner SM. Predicting future
cardiovascular disease: do we need the oral glucose tolerance test? Diabetes
Care 2002;25:1851– 6.
- McNeely MJ, Boyko EJ, Leonetti DL, Kahn SE, Fujimoto WY. Comparison of a
clinical model, the oral glucose tolerance test, and fasting glucose for
prediction of type 2 diabetes risk in Japanese Americans. Diabetes Care
2003;26:758–63.
- National Cholesterol Education Program (NCEP) Expert Panel on Detection,
Evaluation, and Treatment of High Blood Cholesterol in Adults (Adult Treatment
Panel III).Third Report of the National Cholesterol Education Program (NCEP)
Expert Panel on Detection, Evaluation, and Treatment of High Blood Cholesterol
in Adults (Adult Treatment Panel III) final report. Circulation
2002;106:3143–421.
- Lakka HM, Laaksonen DE, Lakka TA, et al. The metabolic syndrome and total
and cardiovascular disease mortality in middle-aged men. JAMA 2002;288:2709
–16.
- Sattar N, Gaw A, Scherbakova O, et al. Metabolic syndrome with and without
C-reactive protein as a predictor of coronary heart disease and diabetes in
the West of Scotland Coronary Prevention Study. Circulation 2003;108:414 –9.
- Trevisan M, Liu J, Bahsas FB, Menotti A. Syndrome X and mortality: a
population based study. Risk Factor and Life Expectancy Research Group. Am J
Epidemiol 1998;148:958–66.
- Pyorala M, Miettinen H, Halonen P, Laakso M, Pyorala K. Insulin resistance
syndrome predicts the risk of coronary heart disease and stroke in healthy
middle-aged men: the 22-year follow-up results of the Helsinki Policemen Study.
Arterioscler Thromb Vasc Biol 2000; 20:538–44.
- Girman CJ, Rhodes T, Mercuri M, et al., 4S Group and the AFCAPS/TexCAPS
Research Group. The metabolic syndrome and risk of major coronary events in
the Scandinavian Simvastatin Survival Study (4S) and the Air Force/Texas
Coronary Atherosclerosis Prevention Study (AFCAPS/TexCAPS). Am J Cardiol
2004;93:136 – 41.
- GISSI-Prevenzione Investigators. Dietary supplementation with n-3
polyunsaturated fatty acids and vitamin E after myocardial infarction: results
of the GISSI-Prevenzione trial. Lancet 1999;354:447–55.
- Bonora E, Kiechl S, Willeit J, et al. Prevalence of insulin resistance in
metabolic disorders: the Bruneck Study. Diabetes 1998;47:1643–9.
- Knowler WC, Barrett-Connor E, Fowler SE, et al. Reduction in the incidence
of type 2 diabetes with lifestyle intervention or metformin. N Engl J Med
2002;346:393– 403.
- Hu FB, Manson JE, Stampfer MJ, et al. Diet, lifestyle, and the risk of
type 2 diabetes mellitus in women. N Engl J Med 2001;345:790 –7.
- Tuomilehto J, Lindstrom J, Eriksson JG, et al. Prevention of type 2
diabetes mellitus by changes in lifestyle among subjects with impaired glucose
tolerance. N Engl J Med 2001;344:1343–50.
- Reaven GM. Banting lecture 1988. Role of insulin resistance in human
disease. Diabetes 1988;37:1595– 607.
- Alberti KG, Zimmet PZ. Definition, diagnosis and classification of
diabetes mellitus and its complications. Part 1: diagnosis and classification
of diabetes mellitus provisional report of a WHO consultation. Diabet Med
1998;15:539 –53.
- Einhorn D, Reaven GM, Cobin RH, et al. American College of Endocrinology
position statement on the insulin resistance syndrome. Endocr Pract
2003;9:237–52.
- Laakso M, Sarlund H, Salonen R, et al. Asymptomatic atherosclerosis and
insulin resistance. Arterioscler Thromb 1991;11:1068 –76.
- Bressler P, Bailey SR, Matsuda M, DeFronzo RA. Insulin resistance and
coronary artery disease. Diabetologia 1996;39:1345–50.
- Howard G, O’Leary DH, Zaccaro D, et al. Insulin sensitivity and
atherosclerosis. The Insulin Resistance Atherosclerosis Study (IRAS)
Investigators. Circulation 1996;93:1809 –17.
- Grundy SM, Cleeman JI, Bairey Merz CN, et al. Implications of recent
clinical trials for the National Cholesterol Education Program Adult Treatment
Panel III guidelines. Circulation 2004;110:227–39.
- Juutilainen A, Kortelainen S, Lehto S, Ronnemaa T, Pyorala K, Laakso M.
Gender difference in the impact of type 2 diabetes on coronary heart disease
risk. Diabetes Care 2004;27:2898 –904.
- Stratton IM, Adler AI, Neil HA, et al. Association of glycaemia with
macrovascular and microvascular complications of type 2 diabetes (UKPDS 35):
prospective observational study. BMJ 2000; 321:405–12.
- Lean ME, Han TS, Morrison CE. Waist circumference as a measure for
indicating need for weight management. BMJ 1995;311:158–61.
- Alberti KG, Zimmet PZ. Definition, diagnosis and classification of
diabetes and its complications, part 1: diagnosis and classification of
diabetes provisional report of a WHO consultation. Diabetic Med 1998;15:539
–53.
- Ridker PM, Buring JE, Cook NR, Rifai N. C-reactive protein, the metabolic
syndrome, and risk of incident cardiovascular events. An 8-year follow-up of
14 719 initially healthy American women. Circulation 2003;107:391–7.
- Sattar N, Gaw A, Scherbakova O, et al. Metabolic syndrome with and without
C-reactive protein as a predictor of coronary heart disease and diabetes in
the West of Scotland Coronary Prevention Study. Circulation 2003;108:414 –9.
- Wildman RP, Gu D, Reynolds K et al. Appropriate body mass index and waist
circumference cutoff for categorization of overweight and central adiposity
among Chinese adults. Am J Clin Nutr 2004;80: 1129–36.
Если вы заметили орфографическую, стилистическую или другую ошибку на этой странице, просто выделите ошибку мышью и нажмите Ctrl+Enter. Выделенный текст будет немедленно отослан редактору
|
|
|
|

