Данная информация предназначена для специалистов в области здравоохранения и фармацевтики. Пациенты не должны использовать эту информацию в качестве медицинских советов или рекомендаций.
Фармакокинетика железа-изомальтозата 1000 у пациентов с
воспалительными заболеваниями кишечника
Kim Nordfjeld
Hans Andreasen
Lans Lykke Thomsen
Parmacosmos A/S, Holbaek, Denmark
Абстракт.
Предпосылки: Железа III гидроксид олигоизомальтозат1000 -это новая
инъекционная форма железа, которая предлагает потенциальные достоинства в
лечении больных с железодефицитной анемией. Мы изучили фармакокинетику этого
нового препарата у пациентов с умеренной и средней степени тяжести
воспалительными заболеваниями кишечника (ВЗК).
Методы: Это открытое перекрестное одноцентровое исследование было
выполнено на 12 пациентах с ВЗК, которые получили лечение по одной из схем с
железа III гидроксид олигоизомальтозатом 1000, вводимым внутривенно болюсно: 100
мг сначала, затем 200 мг или наоборот. Вариабельность фармакокинетики
оценивалась согласно однопуловой модели.
Результаты: Зависимость концентрации препарата от времени для ИСЖ
и ОЖ показали первого порядка ФК с небольшими отклонениями в зависимости от
вводимой дозы. Площадь под кривой AUC, ч*мкг/мл, для ИСЖ при введении сначала
100 мг, а затем 200 мг, была 888 и 2141 соответственно, а для ОЖ – 1010 и 2319
соответственно. Соответствующие максимальные концентрации Cmax , мкг/мл, были
35,6 и 68,6 для ИСЖ и 37,3 и 71,1 для ОЖ соответственно. Период полувыведения
(T1/2) для ИСЖ и ОЖ был между 20,8 и 23,5 часами. Кажущийся объем распределения
(VD) колебался от 3,0 до 3,5 л. Только около 1% от назначенного количества
экскретировалось с мочой. Никаких серьезных нежелательных явлений зафиксировано
не было. Один пациент был выведен из исследования после введения 100 мг
препарата в связи с болью в животе и лихорадкой.
Заключение: В назначенных дозах железа Fe III гидроксид
олигоизомальтозат 1000 показал первого порядка фармакокинетику и не превысил
безопасных значений у больных с ВЗК. Параметры ФК для ИСЖ были близки к таковым
для ОЖ.
Ключевые слова: воспалительное заболевание кишечника,
железодефицитная анемия, лечение железом, Fe III гидроксид олигоизомальтозат
1000, фармакокинетика.
Введение.
Железодефицитная анемия (ЖДА) выявляется примерно у 1,6 млрд. человек на
планете1. При воспалительных заболеваниях кишечника (ВЗК) ЖДА наиболее часто
встречающийся вид анемии, который определяется у около 33% страдающих, вероятно,
в связи с острой фазой заболевания, когда часто возникает кровотечение.
Поддержка железом может быть осуществлена пероральным или внутривенным путями.
Однако, у пациентов с ВЗК около 90% перорального препарата железа не
абсорбируется, проходит через воспаленные участки стенки кишечника и вызывает
местный оксидантный стресс в этих местах. Таким образом, внутривенное введение
предпочтительнее для поддержки железом у больных с ВЗК2.
Fe III гидроксид олигоизомальтозат 1000 (Монофер,
Pharmacosmos A/S, Holbaek, Denmark) – это новая химическая структура,
образованная комплексированием железа гидроксида с олиоизомальтозатом 1000.
Олигоизомальтозат 1000 – это химическая модификация изомальтоолигосахарида со
средней молекулярной массой 1000 Дальтон, состоящая в основном из 3III гидроксид
олигоизомальтозат 1000 (Монофер,
Pharmacosmos A/S, Holbaek, Denmark) – это новая химическая структура,
образованная комплексированием железа гидроксида с олиоизомальтозатом 1000.
Олигоизомальтозат 1000 – это химическая модификация изомальтоолигосахарида со
средней молекулярной массой 1000 Дальтон, состоящая в основном из 35 глюкозных
частей. В отличие от декстранов, олигоизомальтозат 1000 – линейная,
неразветвленная молекула с низким иммунологическим потенциалом, так что тестовая
доза (проба) не обязательна. Fe III гидроксид олигоизомальтозат содержит
связанное железо внутри железо-олигоизомальтозатной матрицы с очень небольшим
количеством токсичного свободного железа3.
Первичной точкой исследования было определение фармакокинетику (ФК) для железа,
связанного с олигоизомальтозатом (ИСЖ), железа, связанного с трансферрином (ТСЖ),
и общим железом (ОЖ) у больных с установленным диагнозом ВЗК, после
внутривенного болюсного введения железа изомальтозида 1000, учитывая возможный
вклад экскреции с мочой в элиминацию ИСЖ из плазмы. Вторичной точкой
исследования было определить толерантность и безопасность
использования железа изомальтозида 1000 у данной группы пациентов.
Материал и методы.
Этические соответствия
Это исследование было выполнено в одном центре в Дании (Фаза один исследования A/S)
в соответствии с Хельсинской Декларацией и по согласованию с Международной
Конференцией по Гармонизации Хорошей Клинической Практики (GCP) и применимыми
регуляторными требованиями. Перед началом исследования протокол исследования
и/или другие относящиеся к делу документы были утверждены Независимым Этическим
Комитетом. Перед тем, как каждый пациент был включен в исследование, от него
было получено подписанное информированное согласие согласно Датским регуляторным
и юридическим требованиям.
Дизайн исследования, результаты и приемлемые критерии
Это было открытое, перекрестное, одноцентровое фармакокинетическое исследование
железа изомальтозида 1000, которое вводилось внутривенно болюсно в дозах 100 мг
или 200 мг пациентам с ВЗК.
Критерии включения: наличие умеренной или средней тяжести ВЗК (язвенный колит
или болезнь Крона) не менее 3-х месяцев, возраст 18-70 лет, ферритин сыворотки
менее 800 мкг/л, сатурация трансферрина менее 30%, ожидание выживаемости не
менее 12 месяцев, уровень гемоглобина 8,9-15,3 г/дл у мужчин и 8,9-13,7 г/дл, у
женщин.
Критерии исключения: наличие тяжелого ВЗК или хирургическое вмешательство менее,
чем за 8 недель до включения в исследование, нежелезодефицитная анемия,
перегрузка железом или гемохроматоз, или гемосидероз, ранее установленная
гиперчувствительность к декстрану железа или монодисахаридному комплексу,
поливалентная аллергия в анамнезе, цирроз печени или гепатит, острые или
хронические инфекции, ревматоидный артрит, беременность или кормление грудью,
активное кровотечение, планируемое элективное хирургическое вмешательство во
время исследования с предполагаемой значимой кровопотерей, участие в любом
другом клиническом исследовании менее чем за 3 месяца до скрининга.
Исследование для каждого включенного продолжалось максимум 7 недель и
состояло из 9 визитов: визит 1 (день -14-день -3), визит 2 (день
-1-рандомизация, день 0 –baseline и дозирование), визит 3 (24 часа после
введения препарата), визит 4 (48 часов после введения препарата), визит 5 (72
часа после введения препарата), «период отмывания» в течение 28 дней, визит 6
(день -1-день повторной госпитализации и введения препарата, визит 7 (24 часа
после введения препарата), визит 8 (48 часов после введения препарата), визит 9
(72 часа после введения препарата и завершения лечения). Визит 9 проводился
также тем, кто получил только одно введение препарата. Пробы крови для
фармакокинетического анализа брались за 30 минут до введения препарата, затем во
время введения, через 5, 10, 15, 30 и 45 минут и через 1, 1,5, 2, 4, 8, 12, 24,
48 и 72 часа после введения препарата.
Fe III гидроксид олигоизомалтозат назначался каждому пациенту дважды как
однократная внутривенная доза, с минимальным интервалом между введениями по 4
недели. Первые 6 пациентов были объединены в группу 1 (100 мг/200 мг), а другие
6 – в группу 2 (200 мг/100 мг). Fe III гидроксид олигоизомалтозат был назначен в
виде инъекции со скоростью введения 50 мг железа в минуту для обеих групп. В
целях безопасности введение препарата каждому пациенту проводили с
30-и минутным интервалом.
ОЖ и ТСЖ определялись в плазме и моче, ИСЖ определялось как разница между ними.
Параметры ФК определялись согласно однопуловой модели и включали максимальную
концентрацию в сыворотке (Cmax), время до достижения Cmax (Tmax), рассчитывали
концентрацию в сыворотке во время введения препарата (C0), достигаемую обратной
экстраполяцией к С0 log-линейной регрессии в точках 12, 24, 48 и 72 часа,
площадь под кривой концентрация-время с момента инъекции до бесконечности (AUCinf
); константа элиминации (Ке), установленная от каждого введения препарата с
помощью log-линейной регрессии в точках 12, 24, 48 и 72 часа, T1/2 установленный
от Ке , и видимый VD, установленный от С0. Моча собиралась в 4 временных
интервала, следующих после каждого введения препарата: 0-8, 8-24, 24-48 и 48-72
часа.
Параметры безопасности включали лабораторные тесты (гематологические,
биохимические и анализы мочи), общий осмотр, витальные функции (АД, ЧСС и
температура тела), электрокардиограмма (ЭКГ), возникновение и тяжесть
нежелательных явлений (АЕs) и нежелательные реакции препарата (ADRs).
Аналитические методы
ИСЖ в сыворотке крови определяли методом дифференциации с помощью Unilabs A/S
(Копенгаген, Дания) (GCP и ISO 17025 аккредитованная лаборатория). Содержание ОЖ
определяли с помощью угольной атомной абсорбционной спектрометрии (GFAAS) с
Zeeman коррекцией, представленной Varian (в настоящее время Agilent Technologies,
Santa Clara, CA). Содержание ТСЖ определяли методом фотометрии на
автоматизированном анализаторе Advia 1650 Chemistry System, представленном Bayer
HealthCare (в настоящее время Siemens HealthCare Diagnostics, Мюнхен, Германия).
Разница результатов GFAAS и фотометрии принималась равной содержанию ИСЖ, при
условии, что свободного железа не было, а количества ферритина были незначимы,
таким образом, формы железа представлены в виде ОЖ, ТСЖ и ИСЖ. Коэффициент
вариации контроля качества GFAAS и Advia находился в диапозоне 7,6% -10,2% для
GFAAS и в диапазоне 1,0% -1,1% для Advia. Средняя погрешность находилась в
диапозоне 1,1%-6,9% для GFAAS и 1,7-3,2% для Advia. GFAAS применялась для
определения общего количества железа в пробе после обработки раствором 65% HNO3
при 115.С, после чего производили десятикратное разведение путем добавления
Triton-X-100.
Линейная кривая калибровки строилась с применением имевшейся в анализаторе
GFAAS программы путем добавления различных стандартов концентраций железа к
человеческой сыворотке, содержащей 43,57 мкмоль/л. Добавляемый раствор
стандартного железа готовился из воды и железа изомальтозида 1000 в концентрации
69,56 мкмоль/л с последующим разведением до необходимой концентрации.
Разница результатов GFAAS и фотометрии принималась равной содержанию ИСЖ, при
условии, что свободного железа не было, а количества ферритина были незначимы,
таким образом, формы железа представлены в виде ОЖ, ТСЖ и ИСЖ. Коэффициент
вариации контроля качества GFAAS и Advia находился в диапозоне 7,6% -10,2% для
GFAAS и в диапазоне 1,0% -1,1% для Advia. Средняя погрешность находилась в
диапозоне 1,1%-6,9% для GFAAS и 1,7-3,2% для Advia. GFAAS применялась для
определения общего количества железа в пробе после обработки раствором 65% HNO3
при 115.С, после чего производили десятикратное разведение путем добавления
Triton-X-100. Линейная кривая калибровки строилась с применением имевшейся в
анализаторе GFAAS программы путем добавления различных стандартов концентраций
железа к человеческой сыворотке, содержащей 43,57 мкмоль/л. Добавляемый раствор
стандартного железа готовился из воды и железа изомальтозида 1000 в концентрации
69,56 мкмоль/л с последующим разведением до необходимой концентрации.
Концентрация ИСЖ в моче также оценивалась с помощью метода дифференциации,
основанном на тех же принципах, что и определение железа в сыворотке крови:
GFAAS –для ОЖ, Advia – для ТСЖ. Качество метода для определения ИСЖ было
удовлетворительным. Коэффициент вариации контроля качества для GFAAS и Advia
находился в интервале 1,1-6,9% для GFAAS и 0,20,4% для Advia. Средняя
погрешность колебалась между 1,8 и 14,9% для GFAAS и между 1,4 и 4,1%
для Advia.
GFAAS аналитический метод применялся для измерения общего количества железа в
пробах мочи после разведения и добавления Triton-X-100. Прибор был линейно
откалиброван с использованием Titrisol-разведенными калибраторами,
произведенными Unilabs A/S. Кривая калибровки имела градацию от 0,0 до 10,1
мкмоль/л. Для определения ТСЖ в моче методом Advia, Fe3+ сначала отделялось от
трансферрина в кислой среде, затем восстанавливалось до Fe2+ с аскорбиновой
кислотой и после объединялось с феррозином (Ferrozine), до образования
хромогенного комплекса, который абсорбируется на длине волны 571/658 нм.
Статистическая обработка.
Перекрестный дизайн – с периодом «отмывки» между двумя введениями различных доз
железа изомальтозида 1000 – образовал парные результаты, которые использовались
во время анализа. Необходимости делать поправку на множественность не было.
Формальный рассчет необходимого объема выборки не проводился. Однако,
основываясь на данных концентрации железа в сыворотке из предыдущих исследований
(данные в файле), коэффициент вариации (CV) средней Сmax у 12 пациентов должен
был быть в интервале 5-7%. Это было принято как достаточная точность для
фармакокинетических точек. Объем выборки из 12 пациентов был достаточным.
Первичные точки фармакокинетики, AUC0-end и Cmax, были log-преобразованы
(логарифмированы) и оценены в смешанной линейной нормальной модели, лечение и
визит являлись фиксированными факторами, пациент – случайным фактором. Фактор
пациента был включен для осуществления перекрестного дизайна.
Все первичные и вторичные точки были представлены сводной статистикой.
Описательные статистики для количественных признаков были представлены с N, где
N означает количество пациентов без пропусков средней, стандартным отклонением (SD),
геометрической средней, и коэффициентом вариации (CV). Для качественных
признаков описательные статистики были представлены N и процентом (%) количества
пациентов без пропусков в различных категориях.
Неблагоприятные (нежелательные) явления.
Нежелательные явления (НЯ) записывались во время всех постскрининговых визитов и
классифицировались согласно Медицинскому Справочнику для контролирующих
деятельностей (MedDRA) системы, версия 10.14.
Результаты.
Характер пациентов и демография.
Из 36 обследованных пациентов в исследование были включены 12 с ВЗК,
установленными по критериям Леннарда-Джонса5. Всем пациентам вводили препарат
дважды (100 мг и 200 мг, 200 мг и 100 мг), завершили исследование все пациенты,
кроме одного, который получил только одно введение 100 мг препарата перед тем,
как был выведен из исследования в связи с неблагоприятными явлениями. У одного
пациента на момент включения определили несколько повышенный уровень креатинина
сыворотки. Демографические данные и данные на начало исследования представлены в
таблице 1.
Фармакокинетические результаты.
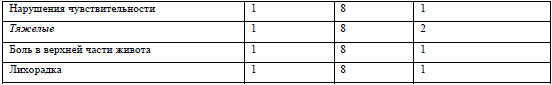
Кривые концентрации в сыворотке в зависимости от времени для ИСЖ, ОЖ и ЖСТ
представлены на рисунке 1 в виде log-преобразованного среднего значения
±стандартная ошибка (SE). Форма кривых ИСЖ и ОЖ сравнима c фармакокинетикой
первого порядка.
Соответствующая описательная статистика (геометрические средние и CV)
представлена в таблице 2. Более чем двукратное повышение было выявлено для
средних значений AUC и Сmax для 200 мг по сравнению со 100 мг. Величина Ке была
несколько ниже, а Т1/2 немного длиннее для 200 мг по сравнению со 100 мг для ИСЖ
и ОЖ (таблица 2). Это соответствует отклонению в зависимости от дозы. Кажущийся
VD колебался от 3,0 до 3,5 л.
Форма кривой, также как и средние значения площади под кривой и Сmax, для ИСЖ
были близки к таковым для ОЖ.
Трансферрин сыворотки прирастал медленно, и достигал Cmax примерно через 5,5
часов, а потом постепенно снижался. Соотношение между площадью под кривой для
ИСЖ и ОЖ составляло 16% для 100 мг и 10% для 200 мг.
Сравнение фармакокинетических значений между двумя перекрестными периодами не
выявило каких-то периодических эффектов (данные не приведены).
В таблице 3 представлены данные по экскреции ОЖ с мочой. Примерно 1% назначенной
дозы выделялся с мочой (0,9% после введения 100 мг и 1,1% после введения 200 мг
препарата). выделялся с мочой (0,9% после введения 100 мг и 1,1% после введения
200 мг препарата).
Безопасность исследования.
Сообщений о серьезных нежелательных явлениях не было. 9 пациентов отметили в
общей сложности 43 несерьезных нежелательных явления: 33 из них были умеренными,
8 – средней степени, 2 –тяжелой степени (таблица 4).
31 явление было классифицировано как связанное с исследуемым препаратом, а 12 –
как несвязанное с исследуемым препаратом. Один пациент был выведен из
исследования в связи со связанным с препаратом нежелательным явлением после
первого введения 100 мг железа изомальтозида 1000. У этого пациента среди 11-и
нежелательных явлений, связанных с препаратом, 2 были расценены как тяжелые
серьезные (абдоминальные боли и лихорадка). Симптомы не были
похожи на острую анафилактическую реакцию; пациенту сразу назначили
антигистаминные средства и глюкокортикоиды для предотвращения острых реакций или
потенциально возможных аллергических реакций. Пациент находился под наблюдением,
и все симптомы, связанные с введением препарата, разрешились. Сообщений о других
серьезных нежелательных явлениях, связанных с введением препарата, у других
пациентов не было. Сообщений о клинически значимых
изменениях в лабораторных параметрах или жизненно важных функциях не было. Среди
всех нежелательных явлений три были в виде локального раздражения, причем из них
два были расценены как связанные с исследуемым препаратом.
Обсуждение
Анемия – наиболее частое системное осложнение ВЗК, которое значимо влияет на
качество жизни. В недавно опубликованном руководстве по диагностике и лечению
анемии и дефицита железа при ВЗК авторы приводят доводы, что при внутривенном
способе введения железо более эффективно, лучше переносится, и улучшает качество
жизни в большей степени, чем при пероральном пути введения2. Данные
фармакокинетики, полученные в этом исследовании, могут
расцениваться как характерные для данной когорты больных, кто может выиграть от
введения железа изомальтозида 1000.
Концентрация ИСЖ в плазме и в моче была связана с концентрацией ОЖ и ЖСТ, если
допустить, что не было выявлено наличие свободного железа, а количество
ферритина было незначимо, поэтому можно заключить, что все железо было
представлено в виде ОЖ, ИСЖ и ЖСТ. Этот так называемый метод дифференциации
применялся также при исследовании фармакокинетики железа глюконата6,7, хотя
фармакокинетика Ferumoxytol (ферумокситола)8,9 базировалась на прямом
определении железа, связанного с препаратом, путем MR-спектрометрии, а
фармакокинетика железа гидроксид-сахарозного комплекса базировалась на
определении ОЖ. Параметры ИСЖ были близкими к таковым ОЖ, что подразумевает, что
ОЖ может быть неплохим суррогатным маркером для ИСЖ. Последние
исследованияпроведенные in vitro показывают, что матричная структура железа
изомальтозида 1000 содержит незначительное количество свободного железа 3,10 .
Факт, что железа декстран, имеющий низкую молекулярную массу, обладает более
высоким содержанием свободного железа, в этих экспериментах выводит на первый
план разницу между этими двумя формами.
свободного железа, в этих экспериментах выводит на первый план разницу между
этими двумя формами. 3,10
Для ОЖ и ИСЖ формы log-преобразованных кривых концентрации в зависимости от
времени согласовались с первым порядком фармакокинетики, который в свою очередь
согласовался с фармакокинетикой декстрана железа в дозе по железу до 500 мг11, и
с фармакокинетикой препарата Ferumoxytol, в дозировке по железу до 4 мг/кг после
однократного внутривенного введения8. Это не выявлялось в случае использования
железа-глюконата6,7 или железа гидроксид-сахарозного комплекса12, оба которых
показали сначала быстрое снижение в течение первых 4-6 часов, которое затем
сопровождалось замедленной элиминацией.
Как для ИСЖ, так и для ОЖ более чем двукратное повышение было выявлено для
площади под кривой и Сmax при введении 200 мг препарата по сравнению со 100 мг,
что объясняется линейной дозозависимостью и коррелирует с фармакокинетикой
Ferumoxytol, который вероятно представляет объем-зависимую элиминацию из плазмы
в ретикуло-эндотелиальную сеть (РЭС), описанную ранее 13 . VD, основанный на
явной начальной концентарции, колебался в пределах 3,0-3,5 л. Это ориентировочно
совпадает с объемом плазмы (обычно 40-50 мл/кг) и сравнимо с другими вводимыми
внутривенно препаратами, кроме железа глюконата, для которого этот показатель в
стабильном состоянии достигал 6,7 л6. Это свидетельствует, что практически все
ИСЖ находится (содержится) в плазме до элиминации ретикуло-эндотелиальной
системой. Анализ фармакокинетики был выполнен, используя однопуловую модель с
фармакокинетикой первого порядка, которую также использовали для исследования
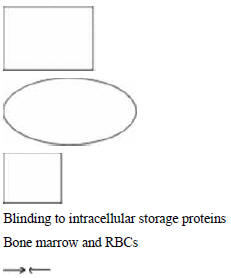
однократного введения препарата Ferumoxytol8. Ряд авторов применяли двупуловую
модель для оценки фармакокинетики железакарбогидратного комплекса; для
повторяющегося введения Ferumoxytol9 и железа глюконата, однако, обе модели
показали примерно одинаковые результаты (описали данные точно). Для железа
карбогидратного комплекса однопуловая модель имеет смысл с физиологической точки
зрения. Согласно данным литературы, внутривенные соединения железа элиминируются
из плазмы ретикуло-эндотелиальной системой (РЭС), которая расщепляет соединение
на железо и карбонат11,12. Будучи разделенным, комплекс уже не может вернуться в
рециркуляцию, таким образом, РЭС-это не хранилище, поскольку нет возврата
комплекса из РЭС в плазму. Правильнее классифицировать РЭС как систему для
элиминации комплекса.
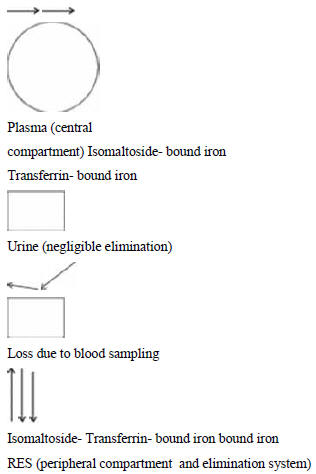
Так, два хранилища могут рассматриваться для ОЖ: плазма (центральное хранилище)
и РЭС (периферическое хранилище) (рисунок 2). РЭС также путь для элиминации ОЖ,
которое потом или соединяется с внутриклеточными накопительными белками
(например, в печени), или транспортируется в костный мозг для участия в
гемопоэзе. Другие способы элиминации включают экскрецию с мочой и потерю во
время взятия анализов крови. Хотя железо, связанное с белками и встроенное в
эритроциты, возвращается в плазму, этот процесс не является частью модели,
поскольку он не возникает до того, как практически все железо будет удалено из
плазмы после назначения железа изомальтозида 1000. ТСЖ не рассматривается как
отдельное хранилище для ОЖ, так как он содержится в плазме (центральном
хранилище). Основываясь на соотношении между АUC для ТСЖ и ОЖ, 10-16% железа,
прописанного (назначенного) как железа изомальтозид, возвращается в плазму из
РЭС, если допустить, что все определяемое ТСЖ происходит из железа
изомальтозидного комплекса. Несмотря на теоретические представления о хранилище
РЭС, форма кривой «концентрация-время» для ОЖ предполагает, что плазма и РЭС
работают как единое пространство с точки зрения фармакокинетики.
ТСЖ не рассматривается как отдельное хранилище для ОЖ, так как он содержится
в плазме (центральном хранилище). Основываясь на соотношении между АUC для ТСЖ и
ОЖ, 10-16% железа, прописанного (назначенного) как железа изомальтозид,
возвращается в плазму из РЭС, если допустить, что все определяемое ТСЖ
происходит из железа изомальтозидного комплекса. Несмотря на теоретические
представления о хранилище РЭС, форма кривой «концентрация-время» для ОЖ
предполагает, что плазма и РЭС работают как единое пространство с точки зрения
фармакокинетики.
Период полувыведения T1/2 для ИСЖ1000 и ОЖ при введении 100 мг препарата
составлял 20,8 и 23,2 часа соответственно, что незначительно меньше, чем период
полувыведения T1/2 для железа декстрана, который составлял примерно 30 часов11,
незначительно больше, чем у Ferumoxytol – примерно 16 часов для дозы 250 мг8, и
значимо больше, чем период полувыведения для железосахарозного комплекса12,
железо-карбоксимальтозы и железа глюконата6,7,14. T1/2 должен быть взят в
рассчет при определении частоты введения препарата. Полученные значения Тmax для
ИСЖ и ОЖ были в диапозоне 27-38 минут. Для сравнения, Tmax для ОЖ после
болюсного введения железа карбоксимальтозы составило 16 минут от момента
введения, и 20, 60 и 72 минуты после 15-и минутной инфузии 500, 800 и 1000 мг
соответственно15.
Экскреция с мочой была незначительной (таблица 3). Общее количество
экскретируемого было 0,9% от введенного количества при дозе 100 мг (0,6-1,1%) и
после введения 200 мг -1,1% (0,7-1,4%). Это подтверждает, что выведение железа
почками, ассоциированное с внутривенной инфузией ИСЖ1000, незначительно, и это
имеет два клинических значения: 1 – железо в виде ИСЖ1000 практически полностью
остается в организме и может применяться для гематопоэза; 2 –почечная
недостаточность не оказывает никакого влияния на элиминацию ОЖ. Для сравнения,
рассчитанные пропорции экскретируемого железа глюконата в моче были 2,4% и 2,3%
после внутривенного введения 62,5 и 125 мг соответственно6. Для железа сахарата
экскреция железа с мочой более важна и составляет 5% в течение первых 4 часов
после введения12 .
Потеря железа из-за сдачи анализов крови в рассчет не бралась. Во время
исследования никаких аллергических реакций определено не было.
Один пациент (субъект) имел множественные нежелательные явления (11 – доложены
на дозе 100 мг) и был выведен из исследования после первого введения препарата.
Несмотря на это, симптоматика не рассматривалась как острая анафилактическая
реакция; пациенту сразу было начало лечение антигистаминными препаратами и
глюкокортикостероидами для предотвращения любого прогрессирования острых реакций
или потенциально возможных аллергических реакций. Пациент находился под
наблюдением и все нежелательные явления купировались.
Не было выявлено корреляции между вводимой дозой и количеством или тяжестью
нежелательных явлений. На основании сообщений о нежелательных явлениях и их
тяжести, исключая выбывшего из исследования пациента, невозможно было выявить
корреляции между НЯ и Сmax или AUC для разных дозировок. Были редкие сообщения о
НЯ и по отчету из брошюры max или AUC для разных дозировок. Были редкие
сообщения о НЯ и по отчету из брошюры исследователя не было явных взаимосвязей
указанными факторами.
Таким образом, железа изомальтозид 1000 (100 мг или 200 мг), вводимый
внутривенно со скоростью не более 50 мг железа/минуту, показал первичный
кинетический профиль как для ЖИМ, так и для ОЖ, и является безопасным в
назначенных дозах для указанной группы больных с ВЗК.
Препарат вводился в дозировках от 100 мг до 1800 мг пациентам хронической
болезнью почек или хронической сердечной недостаточностью, страдающим от
железодефицитной анемии16,17. На основании выполненного исследования, ОЖ может
быть использовано в качестве суррогатного маркера для ИСЖ в будущих
фармакокинетических исследованиях с такими высокими дозами железа изомальтозида
1000.
Сайт препарата Монофер -
www.monofer.ru
Благодарность и предание гласности
Kim Nordfjeld, Hans Andreasen и Lans L Thomsen были наняты Спонсором,
Pharmacosmos A/S. Спонсор вовлекался в дизайн исследования, сбор, анализ и
интерпретацию данных, написание статьи и в решение о допуске статьи к
публикации.
Kim Nordfjeld привлекался к дизайну, проекту управления во время сбора данных,
анализов и подготовки статьи. Hans Andreasen привлекался к дизайну, сбору
данных, анализов и подготовке статьи. Lans L Thomsen привлекался к дизайну,
сбору данных, анализов и подготовке статьи. Все авторы читали и утвердили
конечный вариант статьи.
Благодарность всем авторам статьи, не вошедшим в список авторов: CRO первая фаза
исследования A/S участвовали в сборе данных, доктор Ewa Lindestrom обеспечивала
медицинскую поддержку и внесла научный вклад при подготовке статьи, Jens K Slott
Jensen MSc обеспечивал статистическую обработку. Спонсор оплатил все эти виды
помощи.
Список литературы
1. de Benoist B, McLean E, Egli I, Cogswell M. Worldwide Prevalence of Anaemia
1993–2005: WHO Global Database on Anaemia. Available from http://whqlibdoc.who.int/publications/2008/9789241596657_eng.
pdf. Accessed January 11, 2012.
2. Gasche C, Berstad A, Befrits R, et al. Guidelines on the diagnosis and
management of iron deficiency and anemia in inflammatory bowel diseases. Inflamm
Bowel. 2007;13(12):1545–1553.
3. Jahn MR, Andreasen HB, Futterer S, et al. A comparative study of the
physicochemical properties of iron isomaltoside 1000 (Monofer®), a new
intravenous iron preparation and its clinical implications. Eur J Pharm Biopharm.
2011;78(3):480–491.
4. Medical Dictionary for Regulatory Activities. Maintenanceand Support Services
Organization, 2010. Available from: http://www.meddramsso. com/. Accessed on
January 11, 2012.
5. Lennard-Jones JE, Shivananda S; EC-IBD Study Group. Clinicalunifor-mity of
inflammatory bowel disease at presentation and during the first year of disease
in the north and south of Europe. Eur J Gastroenterol Hepatol.
1997;9(4):353–359.
6. Seligman PA, Dahl NV, Strobos J, et al. Single-dose pharmacokinetics of
sodium ferric gluconate complex in irondeficient subjects. Pharmacotherapy.
2004;24(5):574–583.
7. Warady BA, Seligman PS, DahlNV. Single-dosage pharmacokinetics of sodium
ferric gluconate complex in irondeficient pediatric hemodialysis patients. Clin
J Am Soc Nephrol. 2007;2 (6):1140–1146.
8. Landry R, Jacobs PM, Davis R, Shenouda M, Bolton WK. Pharmacokinetic study of
ferumoxytol: a new iron replacement therapy in normal subjects and hemodialysis
patients. Am J Nephrol. 2005; 25(4):400–410.
9. Pai AB, Nielsen JC, Kausz A, Miller P, Owen JS. Plasma pharmacoki-netics of
two consecutive doses of ferumoxytol in healthy subjects. Clin Pharmacol Ther.
2010;88 (2):237–242. Drug Design, Development and Therapy 2012:6
10. Futterer S, Andreasen H, Jahn M, Nawroth T, Langguth P. Comparison of
nanoparticular iron formulations for parenteral use – are they similar and
readily exchangeable? Poster presented at Jahrestagung 2010 der Deutschen
Pharmazeutischen Gesellschaft; October 4–7, 2010.
11. Henderson PA, Hillman RS. Characteristics of iron dextran utilization in man.
Blood. 1969; 34 (3):357–375.
12. Danielson BG, Salmonson T ,Derendorf H, Geisser P. Pharmacokinetics of iron(III)-hydroxide
sucrose complex after a single intravenous dose in healthy volunteers.
Arzneimittelforschung. 1996;46 (6):615–621.
13. Danielson BG. Structure, chemistry, and pharmacokinetics of intravenous iron
agents. J Am Soc Nephrol. 2004;15(Suppl 2):S93–S98.
14. Ferinject, summary of product characteristics, the electronic Medicines
Compendium (eMC), updated August 11, 2009. Available from: http://
www.medicines.org.uk/EMC/medicine/24167/SPC/Ferinject+(ferric+ carboxymaltose)/.
Accessed January 11, 2012.
15. Australian Public Assessment Report for Ferric Carboxymaltose. TGA May 2011.
Available from: http://www.tga.gov.au/pdf/auspar/auspar-ferric.pdf. Accessed
January 11, 2012.
16. Wikstrom B, Bhandari S, Barany P, et al. Iron isomaltoside 1000: a new
intravenous iron for treating iron deficiency in chronic kidney disease. J
Nephrol. 2011;24(5):589–596. J Nephrol. 2011;24(5):589–596.
17. Hildebrandt PR, Bruun NE, Nielsen OW, et al. Effects of administration of
iron isomaltoside 1000 in patients with chronic heart failure. A pilot study.
Transfus Altern Transfus Med. 2010;11(4):131–137.
Таблица 1 Характеристики больных на скрининге

Таблица 2 Геометрические средние (CV в %) для ИСЖ, ОЖ и ТСЖ

Таблица 3 ОЖ в моче (мкг/мл)
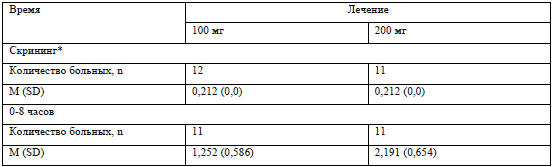
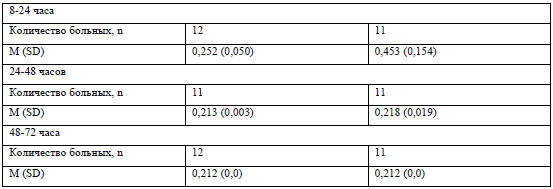
*-концентрация менее нижнего уровня чувствительности метода (LLOQ). Такая
ситуация возникла при определении
концентрации железа в моче как на скрининге, так и через 72 часа. Поэтому,
значения для этих временных промежутков
имеют одинаковые значения.
Таблица 4 Нежелательные явления, связанные с введением
препарата по срокам и тяжести
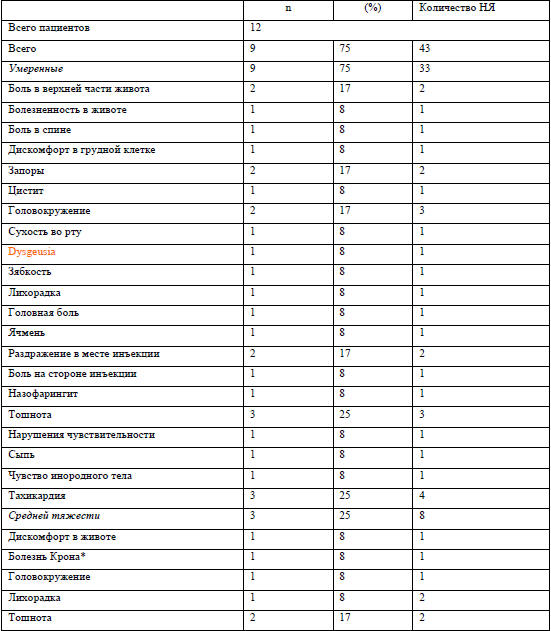
*- ухудшение болезни Крона
Рисунок 1 Концентрация железа в плазме в зависимости от
времени (среднее±SE) (log-преобразованная) А-0-72 часа, В-0-4 часа.
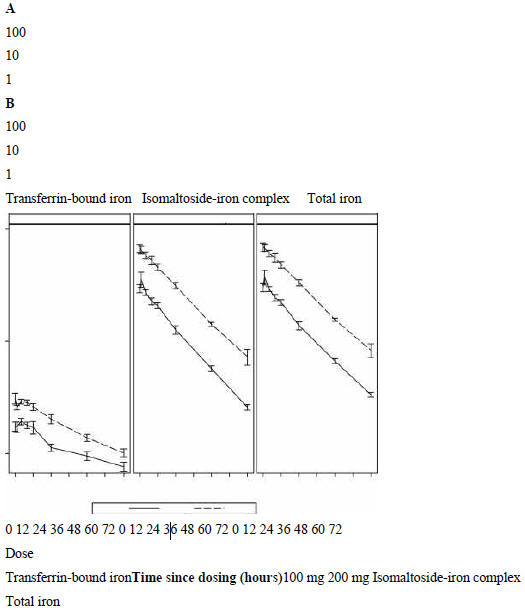
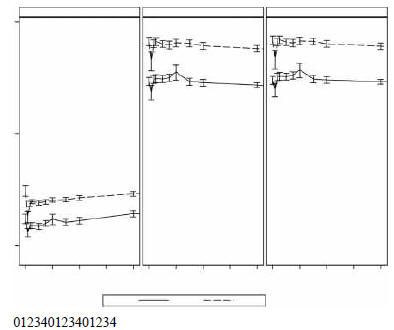
Рисунок 2. Теоретическая дву[пуловая модель для ОЖ