Данная информация предназначена для специалистов в области здравоохранения и фармацевтики. Пациенты не должны использовать эту информацию в качестве медицинских советов или рекомендаций.
Особенности
ведения больных с НПВП-индуцированной гастропатией
Д.И.
Абдулганиева
Государственное бюджетное образовательное
учреждение высшего профессионального образования
«Казанский государственный медицинский
университет» Министерства здравоохранения и
социального развития Российской Федерации
Абдулганиева Диана Ильдаровна
– кандидат медицинских наук, доцент кафедры
госпитальной терапии Казанского государственного
медицинского университета. Контактная информация
для переписки: e-mail: Diana_s@mail.ru; 420012,
Казань, Бутлерова, 49, КГМУ, кафедра госпитальной
терапии
Цель публикации. Продемонстрировать
индивидуальные особенности ведения больных в
зависимости от сочетания патогенетических
механизмов развития НПВП-индуцированной
гастропатии.
Основные положения. В статье приводятся
современные сведения о гетерогенности патогенеза
НПВП-индуцированной гастропатии и собственные
клинические наблюдения вариантов течения данной
патологии у пациентов с ревматоидным артритом.
Заключение. Определенной группе больных
с НПВП-индуцированной гастропатией с клиническим
«перекрестом» болевого и диспептического синдромов
при НПВП-гастропатии симптоматически и
патогенетически обосновано назначение не только
антисекреторных, но и прокинетических препаратов.
Ключевые слова: НПВП-гастропатия,
клинический пример, патогенетическое лечение.
Нестероидные противовоспалительные препараты (НПВП)
– наиболее часто используемые лекарственные
средства в лечебной практике [11]. Более 30 млн
человек в мире употребляют НПВП ежедневно как
обезболивающие, противовоспалительные и
антиагрегантные средства [18].
Основной круг потребителей НПВП составляют
больные с хронической патологией суставов, при
которых боль и воспаление являются основными
клиническими проявлениями [9]. К сожалению,
клинические достоинства НПВП ограничиваются риском
развития серьезных осложнений. Наиболее
распространенной и опасной, нежелательной
реакцией, возникающей при приеме НПВП, является
НПВП-индуцированная гастропатия [3].
Медико-социальная значимость проблемы такова,
что ревматологи (а именно в ревматологической
практике эти препараты назначаются наиболее часто)
называют НПВП-гастропатию «второй ревматической
болезнью» [10]. Предложенным в 1986 г. S.H. Roth
термином NSAID-gastropathy (НПВП-гастропатия) в
мире принято обозначать эрозивно-язвенные
поражения гастродуоденальной зоны, связанные с
приемом этих препаратов и имеющие характерную
клинико-эндоскопическую картину [11, 23].
Необходимо отметить, что в последние несколько лет
в литературе активно обсуждается
НПВП-индуцированное поражение не только
гастродуоденальной области, но и пищевода при
приеме препаратов этой группы [4].
Патогенез НПВП-гастропатии включает в себя
несколько механизмов [30]. Ключевую роль играет
ингибирование фермента циклооксигеназы (ЦОГ),
имеющего два изомера ЦОГ-1 и ЦОГ-2. Угнетение
активности ЦОГ-1 (структурной) приводит к снижению
синтеза простагландинов PgE2 и PgI2, которые
выполняют «цитопротективную» функцию в слизистой
оболочке желудка [11]. Спектр основных
физиологических эффектов простагландинов включает:
стимуляцию секреции защитных гидрокарбонатов и
слизи; усиление местного кровотока слизистой
оболочки; активацию пролиферации клеток в
процессах нормальной регенерации [7]. Угнетение
активности ЦОГ-2 (индуцированной) собственно и
определяет противовоспалительное действие. Таким
образом, снижение синтеза простагландинов, а
следовательно, защитных резервов слизистой
оболочки желудка и двенадцатиперстной кишки (ДПК)
является основной причиной НПВП-гастропатии.
Однако простагландиновый механизм не является
единственным объяснением неблагоприятного влияния
НПВП на слизистую оболочку [27]. Известно, что
эффектами, оказываемыми НПВП, являются: снижение
кровотока слизистой оболочки, зависящее не только
от простагландинового, но и от секреторного
фактора, непосредственное изменение секреции
соляной кислоты, образование «белых тромбов» [20,
27, 29] как последствие воспалительной адгезии
нейтрофилов на сосудистый эндотелий [16, 17],
изменение молекул эндотелиальной и лейкоцитарной
адгезии [30], а также функции эндотелия сосудов в
месте воспаления [28]. Определенный интерес с
практической точки зрения представляет и изменение
на фоне приема НПВП моторики верхних отделов
желудочно-кишечного тракта (ЖКТ) [25], которое
приводит к усугублению язвенно-геморрагических
повреждений слизистой [22, 26, 27]. До настоящего
времени не совсем ясно значение Helicobacter
pylori в патогенезе НПВП-гастропатии [6].
Кроме того, известен и топический эффект НПВП
на слизистую оболочку, который не связан с
простагландиновым механизмом. Прямое «контактное»
повреждающее действие НПВП обусловлено их
способностью непосредственно проникать в клетки
эпителия в кислой среде, где они вызывают обратную
диффузию Н+, нарушают качество слизи и снижают
концентрацию бикарбонатов [8, 29]. Вследствие
этого слизистая оболочка желудка становится более
доступной для местного токсического повреждения
соляной кислотой, желчными кислотами и кислотными
печеночными метаболитами НПВП, панкреатическими
ферментами на фоне дуоденогастрального рефлюкса
[11, 19, 21].
Таким образом, патогенетические механизмы,
вызывающие развитие НПВП-гастропатии, являются
крайне гетерогенными.
Эрозивно-язвенные поражения желудка и ДПК
(сопровождающиеся диспепсией или бессимптомные)
обнаруживаются при эндоскопическом исследовании
практически у 40% больных, длительно принимающих
НПВП [6].
Симптоматика рассматриваемой патологии хорошо
известна клиницистам. Это боли (чаще в
эпигастральной области), связанные с приемом
препарата (пациенты переходят на его прием после
еды, чтобы снизить неприятные ощущения),
диспептический синдром – ощущение тяжести после
еды, чувство быстрого насыщения, вздутие в области
эпигастрия, реже – тошнота, рвота. Для болевого и
диспептического синдромов не характерна сезонность
в отличие от «классической» язвенной болезни.
Клинически НПВП-ассоциированные повреждения
пищевода проявляются симптоматикой
гастроэзофагеальной рефлюксной болезни (ГЭРБ) –
прежде всего изжогой [4, 12].
Следует особо подчеркнуть дисбаланс между
клиническими проявлениями НПВП-гастропатии и
выраженностью эндоскопической картины. Примерно у
30–40% обследуемых, получающих длительную (более 6
нед) терапию НПВП, отмечаются симптомы диспепсии,
которые не коррелируют с данными, полученными при
эзофагогастродуоденоскопии (ЭГДС). Так, до 40%
больных с эрозивно-язвенными изменениями слизистой
верхних отделов ЖКТ не предъявляют жалоб, и,
наоборот, до 50% пациентов с диспепсией имеют
нормальную слизистую оболочку [6].
С позиций практикующего врача необходимо
помнить, что у лиц, предъявляющих жалобы на
неприятные ощущения со стороны ЖКТ и имеющих
эндоскопические признаки, характерные для
НПВП-гастропатии, серьезные осложнения выявляются
чаще, чем у тех, кто не испытывает неприятных
ощущений [6]. Эта группа больных с клиническими и
эндоскопическими проявлениями НПВП-гастропатии
должна находиться под особым наблюдением лечащего
врача.
Случай из клинической практики
Больная Т., 42 лет, поступила в
ревматологическое отделение с диагнозом «ревматоидный
артрит: полиартрит, медленно прогрессирующее
течение, серопозитивный (по анти-MCV), активность
2 (DAS 28 – 6,3), рентгенологическая стадия 2,
функциональная недостаточность суставов 2-й
степени». При поступлении жалобы на ноющие боли,
усиливающиеся при движении, периодическую
припухлость мелких суставов кистей, правого
локтевого и лучезапястных суставов, утреннюю
скованность продолжительностью до 2 ч, эпизоды
субфебрильной температуры. Пациентку беспокоили
также выраженный дискомфорт в эпигастральной
области, чувство тяжести и ощущение переполнения
после приема пищи, иногда сопровождающиеся болью,
горечь во рту, усиливающуюся после еды, отрыжка
воздухом вне зависимости от приема пищи, изжога
3–4 раза в неделю.
Из анамнеза заболевания: страдает ревматоидным
артритом (РА) с 2007 г., в настоящее время
принимает метипред 8 мг/сут, сульфасалазин 2 г/сут,
периодически при усилении суставного синдрома –
диклофенак натрия в дозе 50–150 мг/сут (старается
принимать его после еды, запивать молоком), при
дискомфорте в животе принимала антациды. Не курит,
алкоголем не злоупотребляет, наследственность не
отягощена, язвенной и гастроэзофагеальной болезни
в анамнезе нет. В течение примерно последнего
месяца жалобы на ухудшение состояния в виде
усиления суставного синдрома, утренней
скованности. Самостоятельно возобновила прием
диклофенака натрия в дозе 100 мг, в последующем
150 мг в сутки. Скованность и боли в суставах
стали значительно меньше, однако при повышении
дозы НПВП до 150 мг/сут отмечает появление
диспептического синдрома, выраженной изжоги и
периодических болей «под ложечкой».
Объективно: состояние удовлетворительное,
телосложение нормостеническое, кожные покровы
чистые, язык у корня обложен белым налетом. Правый
и левый лучезапястный суставы, правый локтевой
сустав – без признаков деформации, болезненность
при пальпации, ограничение в объеме пассивных и
активных движений, мелкие суставы кистей и стоп –
без видимых признаков воспаления, болезненность
при пальпации. Тоны сердца ясные, ритмичные,
слегка приглушены, АД 115/70 мм рт. ст., пульс 72
удара в минуту. Дыхание везикулярное, проводится
по всем полям, хрипы не выслушиваются. Живот при
пальпации мягкий, чувствительный в эпигастральной
области, симптом Менделя слабо положительный;
перкуторные размеры hepar et lien не увеличены.
Симптом Пастернацкого отрицательный с обеих
сторон.
Лабораторно-инструментальные методы
исследования: в общем анализе крови отмечено
повышение СОЭ до 28 мм/ч, Hb – 113 г/л.
Ревматоидный фактор положительный.
Результаты ЭГДС: пищевод свободно проходим,
слизистая гиперемирована в нижних отделах,
слизистая желудка диффузно резко гиперемирована
(по типу «пылающей слизистой»), в антральном
отделе имеются множественные подслизистые
кровоизлияния, в полости – мутная, пенистая желчь
объемом до 200 мл, привратник проходим, луковица
ДПК умеренно раздражена. Цитология на Helicobacter
pylori положительная.
Пациентке было проведено суточное
рН-мониторирование (рис. 1), которое является
прямым методом оценки состояния желудочной
секреции и косвенным методом оценки моторики:
колебания уровня рН до 7,0 и выше в теле желудка
свидетельствуют о наличии и выраженности
дуоденогастрального рефлюкса, ниже 4,0 в пищеводе
– о гастроэзофагеальном рефлюксе (ГЭР) [2, 13].
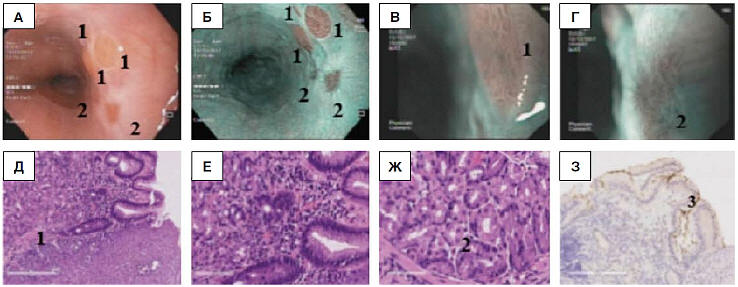
Рис. 1. Суточная
рН-метрия больной Т., 42 лет, страдающей
ревматоидным артритом
Как видно из представленных на рисунке данных,
у больной отмечался выраженный ГЭР (стрелками на
графике пищевода обозначены эпизоды
продолжительных рефлюксов с рН<4). Общее время в
пищеводе с рН<4 составило 13% (в норме 4,5%), с рН<4
стоя – 28% (в норме 8,4%), лежа – 5% (в норме
3,5%), общее число ГЭР – 76 (в норме 46,9), число
ГЭР более 5 мин – 7 (в норме 3,5), показатель
DeMeester (объективный показатель различия
физиологического и патологического рефлюкса) –
38,08 (норма<14,72). В теле желудка в вечерние и
особенно ночные часы – также наличие
дуоденогастральных рефлюксов (обозначено
стрелками).
Клинический диагноз: НПВП-гастропатия с
поражением антрального отдела, активная стадия, H.
pylori (+); ГЭРБ – поверхностный эзофагит
(вероятно, НПВП-индуцированный); ревматоидный
артрит – полиартрит, медленно прогрессирующее
течение, серопозитивный (по анти-MCV), активность
2 (DAS 28 – 6,3), рентгенологическая стадия 2,
функциональная недостаточность суставов 2-й
степени.
Пациентке назначен стол № 1, отменен диклофенак
натрия, назначен омепразол 20 мг/сут, из-за
невыраженности суставного синдрома принято решение
воздержаться от селективных НПВП, продолжена
терапия метипредом и сульфасалазином.
На фоне проводимого лечения купировалась
изжога, практически уменьшились боли в животе.
Вместе с тем к концу недели терапии не только
сохранялся, но и несколько усилился диспептический
синдром. Были выполнены повторная ЭГДС, которая
выявила некоторую динамику в виде уменьшения
гиперемии слизистой оболочки желудка, и повторная
суточная рН-метрия (рис. 2).
Рис. 2 .
Суточная рН-метрия той же больной через 6 дней от
начала приема ингибитора протонной помпы (ИПП)
При анализе 24-часовой рН-граммы отмечено, что
в динамике индекс DeMeester снизился до 10,86,
однако сохранялись дуоденогастральные рефлюксы в
теле желудка (пики на рН-грамме указаны
стрелками), которые в определенной степени могли
объяснить устойчивость диспептического синдрома к
терапии. Эффект ингибиторов протонной помпы (ИПП)
представлен на рисунке подъемом рН в теле желудка
выше 4 (в дневные часы).
К лечению был добавлен ганатон (итоприд) 150
мг/сут. Выбор именно этого прокинетика обусловлен
тем, что при его применении сведен к минимуму риск
лекарственного взаимодействия, так как итоприд
метаболизируется минуя систему цитохрома Р-450,
что важно учитывать при назначении пациенту
одновременно нескольких препаратов. Кроме того,
всасывание и эффективность итоприда не зависят от
рН желудочного содержимого.
В динамике уже на 3-й день лечения было
достигнуто полное клиническое благополучие со
стороны органов ЖКТ. Вопрос о проведении
эрадикации был отложен до полной эндоскопической
нормализации слизистой оболочки, поскольку хорошо
известна побочная реакция эрадикационной терапии в
виде появления диспепсии. Дальнейшими
рекомендациями в ведении больной был переход на
селективные ингибиторы ЦОГ-2 в сочетании с ИПП и
топические НПВП в случае усиления суставного
синдрома.
Таким образом, наблюдавшейся пациентке,
страдавшей ревматоидным артритом,
НПВП-гастропатией и, вероятно, НПВП-эзофагитом, с
клиникой болевого, диспептического синдромов,
изжогой и эндоскопической картиной поражения
слизистой оболочки, было проведено
патогенетическое лечение ИПП и прокинетиками с
целью предупреждения развития грозных осложнений.
Обсуждение результатов наблюдения
Спектр лекарственных средств, используемых для
лечения НПВП-гастропатии, широк и включает в себя
антациды, препараты висмута, аналоги
простагландина, антисекреторные средства
(Н2-блокаторы, ИПП), прокинетики. Однако
эффективность каждого из них различна и зависит от
многих факторов [6]. Убедительная доказательная
база на сегодняшний день имеется только у аналогов
простагландина, ИПП, Н2-блокаторов. Длительность
лечения данными препаратами должна быть не менее 4
нед; при наличии язвенного дефекта большого
размера или его локализации в желудке – 8–12 нед
непрерывной терапии. Многие положения, которые
определяют лечение НПВП-индуцированного поражения
гастродуоденальной области, имеют подтвержденный
уровень доказательности [5].
- Н2-блокаторы в стандартных дозах эффективны
при лечении НПВП-индуцированых язв и эрозий
двенадцатиперстной кишки, но не желудка (уровень
А).
- Мизопростол 200 мг 4 раза в сутки эффективен
в лечении НПВП-индуцированных язв желудка и
двенадцатиперстной кишки (уровень А), но в дозе
600–800 мг/сут у большинства пациентов вызывает
диарейный синдром.
- ИПП (омепразол, лансопразол, эзомепразол)
эффективны в лечении НПВП-индуцированных язв
желудка и двенадцатиперстной кишки (уровень А).
По своему лечебному действию они превосходят
блокаторы Н2-гистаминорецепторов и мизопростол
(уровень А).
- Эрадикация Helicobacter pylori не ускоряет
заживление НПВП-индуцированных язв (уровень А).
Обследованная нами пациентка Т. в качестве
лечения НПВП-гастропатии и, вероятнее всего,
НПВП-индуцированного поражения пищевода получала
ИПП, на фоне приема которого отмечалась
положительная динамика – полностью купировалась
изжога и значительно уменьшился болевой синдром.
Однако диспепсия при приеме ИПП сохранялась и
беспокоила даже несколько сильнее. Данную
клиническую симптоматику можно объяснить
нарушением моторики гастродуоденальной зоны и,
возможно, формированием дуоденогастрального
рефлюкса [1].
Проведенное нами в дальнейшем наблюдение за
клинически значимой подгруппой больных РА с
сочетанием абдоминального болевого,
диспептического синдромов и изжоги при
возникновении НПВП-гастропатии позволило выявить у
них аналогичные изменения при проведении суточной
рН-метрии (рис. 3 и 4).
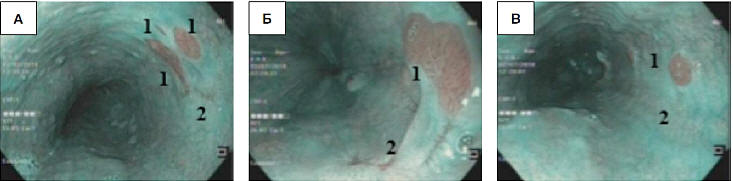
Рис. 3. Суточное
мониторирование пациента Б., 44 лет, с РА (индекс
DeMeester 45,20)
Рис. 4.
24-часовая рН-грамма пациентки Г., 39 лет, с РА
(индекс DeMeester 21,58)
Назначение прокинетиков (в частности, итоприда)
при НПВП-гастропатии с диспептическим синдромом
патогенетически обосновано вследствие их
способности к нормализации двигательной активности
верхних отделов пищеварительного тракта и
уменьшению частоты спонтанных расслаблений нижнего
пищеводного сфинктера [24]. По рекомендациям
Российской гастроэнтерологической ассоциации 2010
г. итоприд внесен как препарат 1-й линии для
лечения ГЭРБ и функциональной диспепсии [14, 15].
При НПВП-гастропатии, как нами уже отмечалось
выше, одним из патогенетических звеньев,
усугубляющих ЦОГ-опосредованный механизм
возникновения повреждения слизистой верхних
отделов ЖКТ, является нарушение моторики.
Заключение
Для купирования клинической симптоматики и
осуществления патогенетической коррекции
определенной группе больных с клиническим
«перекрестом» болевого и диспептического синдромов
при НПВП-гастропатии симптоматически и
патогенетически обосновано назначение не только
антисекреторных, но и прокинетических препаратов.
Список литературы
- Буеверов А.О., Лапина Т.Л.
Дуоденогастроэзофагеальный рефлюкс как причина
рефлюкс-эзофагита // Фарматека. – 2006. – № 1. –
С. 1–5.
- Ильченко А.А. Селезнева Э.Я. Компьютерная
рН-метрия желудка и пищевода. Клиническое
значение метода: Методические рекомендации № 15.
– М.: Департамент здравоохранения Правительства
Москвы, 2001. – 40 с.
- Каратеев А.Е., Насонов Е.Л.
НПВП-ассоциированная патология ЖКТ: реальное
состояние дел в России // Рус. мед. журн. –
2006. – № 15. – С. 1073–1078.
- Каратеев А.Е., Успенский Ю.П., Пахомова И.Г.
и др. Прием НПВП и патология пищевода: связь с
основными симптомами гастроэзофагеальной
рефлюксной болезни (ГЭРБ), частота развития и
факторы риска эрозивного эзофагита // Эксперим.
клин. гастроэнтерология. – 2008. – № 3. – С.
11–16.
- Каратеев А.Е., Яхно Н.Н., Лазебник Л.Б. и
др. Применение нестероидных
противовоспалительных препаратов. Клинические
рекомендации. – М.: ИМА пресс, 2009. – 167 с.
- Ким В.А. НПВП-гастропатия и роль
простагландинов в ее возникновении, профилактике
и лечении // Эксперим. клин. гастроэнтерология.
– 2008. – № 8. – С. 84–91.
- Лапина Т.Л. Гастропатии, индуцированные
нестероидными противовоспалительными
препаратами: клиническое значение, лечение,
профилактика // Consilium Medicum. – 2001. – Т.
3, № 9. – С. 438–442.
- Маев И.В., Вьючнова Е.С., Лебедева Е.Г.
Место ингибиторов протонной помпы в терапии
гастропатий, индуцированных приемом нестероидных
противовоспалительных препаратов // Клин.
перспективы гастроэнтерол. гепатол. – 2006. – №
6. – С. 16–23.
- Насонов Е.Л., Лазебник Л.Б., Мареев В.Ю. и
др. Применение нестероидных
противовоспалительных препаратов: Клинические
рекомендации. – М., 2006.
- Насонова В.А. Рациональная фармакотерапия
ревматических заболеваний: Руководство для
практических врачей / Под общ. ред. В.А.
Насоновой, Е.Л. Насонова. – М.: Литтерра, 2003.
– 507 с.
- Новиков В.Е., Крюкова Н.О., Крикова А.В.
НПВП-индуцированные гастропатии и их
профилактика // Обзоры по клинической
фармакологии и лекарственной терапии. – 2008. –
Т. 6, № 1. – С. 26–30.
- Пахомова И.Г. НПВП-индуцированные поражения
желудочно-кишечного тракта: проблемы,
особенности и пути решения // Consilium Medicum.
– 2009. – № 2. – С. 71–76.
- Рапопорт С.И., Лакшин А.А., Ракитин Б.В.
рН-метрия пищевода и желудка при заболеваниях
верхних отделов пищеварительного тракта / Под
ред. Ф.И. Комарова. – М., 2005. – 208 с.
- Российская Гастроэнтерологическая
Ассоциация. Диагностика и лечение
гастроэзофагеальной рефлюксной болезни: Пособие
для врачей. – М., 2010. – 20 с.
- Российская Гастроэнтерологическая
Ассоциация: Рекомендации по обследованию и
лечению больных функциональной диспепсией, 2011.
- Asako H., Kubes P., Wallace J. et al.
Modulation of leukocyte adhesion in rat
mesenteric venules by aspirin and salicylate //
Gastroenterology. – 1992. – Vol. 103. – P.
146–152.
- Asako H., Kubes P., Wallace J. et al.
Indomethacin-induced leukocyte adhesion in
mesenteric venules: role of lipoxygenase
products // Am. J. Physiol. Gastrointest. Liver
Physiol. – 1992. – Vol. 262. – P. 903–908.
- Baum C., Kennedy D.L., Forbes M.B.
Utilization of nonsteroidal anti-inflammatory
drugs // Arthritis Rheum. – 1985. – N 28. – P.
686–692.
- Gurtis W.D., Griffin J.W. NSAID-induced
gastro-duodenal injury // Ther. Recommendation.
Aliment. Pharmacol. – 1991. – Vol. 5 (suppl. 1).
– Р. 99–109.
- Kitahora T., Guth P.H. Effect of aspirin
plus hydrochloric acid on the gastric mucosal
microcirculation // Gastroenterology. – 1987. –
Vol. 93. – P. 810–817.
- Lanza F.L. Endoscopic studies of gastric and
duodenal injury after the use of ibuprofen,
aspirin, and other nonsteroidal
anti-inflammatory agents // Am. J. Med. – 1984.
– N 77. – P. 19–24.
- Mersereau W., Lehotay D.C., Hinchey E.J.
Relative roles of acid and mucosal compression
in ulcerogenesis in indomethacin-insulin-treated
rat // Dig. Dis. Sci. – 1988. – Vol. 33. – P.
1454–1458.
- Roth S.H. Non-steroidal anti-inflammatory
drug gastropathy: We started in-can we step it?
// Arch. Intern. Med. – 1986. – Vol. 146. – P.
1075–1076.
- Scarpellini E., Vos R., Blondeau K. et al.
The effects of itopride on oesophageal motility
and lower oesophageal sphincter function in man
// Aliment. Pharmacol. Ther. – 2011. – Vol. 33,
N 1. – P. 99–105.
- Takeuchi K., Tanaka A., Hayashi Y. et al.
COX inhibition and NSAID-inducedgastric
damage-roles in various pathogenic events //
Curr. Top. Med. Chem. – 2005. – Vol. 5, N 5. –
P. 475–486.
- Ueki S., Takeuchi K., Okabe S. Gastric
motility is an important factor in the
pathogenesis of indomethacin-induced gastric
mucosal lesions in rats // Dig. Dis. Sci. –
1988. – Vol. 33. – P. 209–216.
- Wallace J.L. Prostaglandins, NSAIDs, and
gastric mucosal protection: why doesn’t the
stomach digest itself // Physiol. Rev. – 2008. –
Vol. 88. – P. 1547–1565.
- Wallace J.L., Arfors K.E., McKnight G.W. A
monoclonal antibody against the CD18 leukocyte
adhesion molecule prevents indomethacin-induced
gastric damage in the rabbit // Gastroenterology.
– 1991. – Vol. 100. – P. 878–883.
- Wallace J.L., Keenan C.M., Granger D.N.
Gastric ulceration induced by non-steroidal
anti-inflammatory drugs is a
neutrophil-dependent process // Am. J. Physiol.
Gastrointest. Liver Physiol. – 1990. – Vol. 259.
– P. 462–467.
- Wallace J.L., McKnight W., Miyasa-ka M. et
al. Role of endothehial adhesion molecules in
NSAID-induced gastric mucosah injury // Am. J.
Physiol. Cell Physiol. – 1993. – Vol. 265. – P.
993–998.
Статья опубликована на сайте
http://www.gastroscan.ru

